- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Направление окислительно-восстановительного процесса
Содержание
- 2. Окислительно-восстановительными реакциями называют реакции, сопровождающиеся изменением степени окисления элементов.
- 3. Почему одни из окислительно - восстановительных протекают,
- 4. Ox + ne ⇔ RedОкисл. Восстан.форма формаOx и Red взаимосвязаны и это есть окислительно-восстановительная пара (редоксипара).
- 5. Общая схема процесса:Ox1+Red2 ⇔ Red1+Ox2окислитель I+
- 6. Стандартный (нормальный) окислительно-восстановительный потенциал пар, которые являются
- 8. Электродвижущая сила ЭДС = Е⁰ок-Е⁰востЭДС>0 процесс протекает самопроизвольно в прямом направлении, при ЭДС
- 9. Опыт 1. Сравнение химической активности железа и
- 10. Сu + FeSO4→ реакция не идет; ∆Е=
- 11. Опыт 2. Взаимодействие раствора соли железа (III)
- 12. KJ + FeCl3 → FeCl2 + KCl
- 13. KBr + FeCl3 →2Br- - 2e →
- 14. Задание 1. Какая из приведенных ниже систем
- 15. Fe3+ е = Fe2+
- 16. MnO4- +8H+ +5е =Мn2+ +4Н2О
- 17. МnО4- + 8Н+ +5е = Мn2++ 4
- 18. Вывод: а)МnО4- + 8Н+ +5е = Мn2++
- 19. Все три реакции протекают самопроизвольно, т.к. ЭДС›0.Окислительные
- 20. Опыт 3. Окислительные свойства перманганата калия. В
- 21. 2KMnO4 + H2O+3Na2SO3=
- 22. Опыт 4. Влияние среды на окислительно-восстановительный
- 23. CrO42- + 2H+ = Cr2O7 2- +H2Oжелтая
- 24. Cr2O7 2-+ 14H+ +6e = 2Cr3+ +
- 25. 2K2CrO4 + H2SO4=К2Cr2O7+ K2SO4 +H2OK2Cr2O7+ 2KOH=2K2CrO4 +
- 26. Ограничено ли прогнозирование окислительно-восстановительных реакций? Можно ли
- 27. Реакция горения ацетилена:С2Н2 + О2 = 5/2
- 28. Черный порох: +5
- 29. Скачать презентацию
- 30. Похожие презентации
Окислительно-восстановительными реакциями называют реакции, сопровождающиеся изменением степени окисления элементов.






















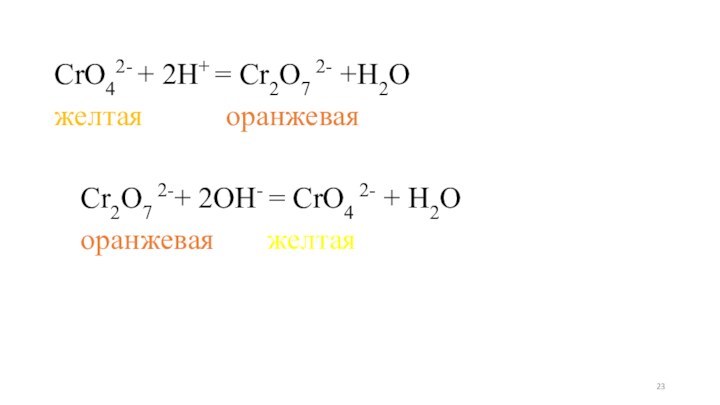






Слайд 2 Окислительно-восстановительными реакциями называют реакции, сопровождающиеся изменением степени окисления
элементов.
Слайд 3 Почему одни из окислительно - восстановительных протекают, а
другие нет?
Почему один и тот же окислитель реагирует с
одним восстановителем и не реагирует с другим?Полностью ли всякий раз происходит превращение взятых в реакцию веществ?
Что именно, или какая сила движет эти реакции?
Слайд 4
Ox + ne ⇔ Red
Окисл. Восстан.
форма форма
Ox и Red взаимосвязаны и это есть окислительно-восстановительная
пара (редоксипара).
Слайд 5
Общая схема процесса:
Ox1+Red2 ⇔ Red1+Ox2
окислитель I+ восстановитель
II= восстановитель I + окислитель II
Окислительно-восстановительные реакции протекают
в сторону образования более слабых окислителей и восстановителей из более сильных.Слайд 6 Стандартный (нормальный) окислительно-восстановительный потенциал пар, которые являются растворимыми
формами, - это разница потенциалов, которая возникает между стандартным
водородным и неактивным (платиновым) электродом, погруженным в раствор, который содержит окисленную и восстановленную формы одной редокс-пары (при 25 °С и активности компонентов пары, равных 1 моль/дм3).
Слайд 8
Электродвижущая сила
ЭДС = Е⁰ок-Е⁰вост
ЭДС>0 процесс протекает самопроизвольно
в прямом направлении, при ЭДС
энергичнее протекает реакция.Реакция будет протекать до тех пор, пока потенциалы обеих пар не станут равными, в системе устанавливается равновесие.
Слайд 9 Опыт 1. Сравнение химической активности железа и меди.
Предварительно обезжиренную и протравленную в соляной кислоте железную пластинку
опустите в раствор сульфата меди (II). Медную пластинку опустите в раствор сульфата железа (II). Спустя некоторое время выньте пластины из растворов. Объясните наблюдаемое, указав стандартные электродные потенциалы соответствующих систем.
Слайд 10
Сu + FeSO4→ реакция не идет;
∆Е=
E(Fe+2\Fe)- E(Cu2+\Cu)= -0,44-0,34= -0,78 В,
реакция невозможна, ЭДС‹0Fe + CuSO4→ Сu+FeSO4
∆Е = E(Cu2+\Cu) - E(Fe+2\Fe) = 0,34-(-0,44)=0,78 В, реакция протекает самопроизвольно с выделением металлической меди, ЭДС › 0
Слайд 11
Опыт 2. Взаимодействие раствора соли
железа (III) с
иодидом калия, с бромидом натрия.
К подкисленному раствору соли
Fe(III) прилейте раствор иодида калия. Проверьте, будет ли протекать реакция при сливании раствора железа (III) и раствора бромида натрия. Объясните наблюдаемое, указав стандартные электродные потенциалы соответствующих систем.
Слайд 12 KJ + FeCl3 → FeCl2 + KCl +
J2
2J- - 2e → J20
EJ2\2J-= 0,536 восстановительFe+3 + 1e → Fe+2 EFe3+\Fe2+ = 0,771 окислитель
2KJ + 2FeCl3 = 2FeCl2 + 2KCl + J2
ЭДС = 0,235, реакция протекает самопроизвольно ЭДС › 0
Следовательно, реакция будет идти в сторону образования свободного иода и ионов железа (II).
Слайд 13
KBr + FeCl3 →
2Br- - 2e → Br20
EBr2\2Br-= 1,065
восстановительFe+3 + 1e → Fe+2 EFe3+\Fe2+ = 0,771 окислитель
2KBr + 2FeCl3 →
ЭДС ˂ 0
Отрицательное значение э.д.с. показывает, что хлорид железа (III) не будет окислять бромид калия.
Слайд 14 Задание 1. Какая из приведенных ниже систем будут
восстановителем, если в качестве окислителя использовать кислый раствор перманганата
калия? Какой из них будет самым сильным восстановителем?Fe3+ е = Fe2+ F2 +2e =2F- Co3+ +e=Co2+ S +2H+ +2e =H2S Pb4+ + 2e = Pb2+ I2 +2e = 2I-
MnO4- +8H+ +5е =Мn2+ +4Н2О
Слайд 15 Fe3+ е = Fe2+
Е=0,771 В
F2 +2e =2F- Е=2,87 В
S +2H+ +2e =H2S Е=0,17 В
Pb4+ + 2e = Pb2+ Е=1,694 В
Co3+ +e' =Co2+ Е=1,808
I2 +2e = 2I- Е=0,536 В
MnO4- +8H+ +5е =Мn2+ +4Н2О E=1,507
Слайд 16 MnO4- +8H+ +5е =Мn2+ +4Н2О
E=1,507
Восстановителем могут быть системы, где электродный потенциал меньше электродного
потенциала подкисленного раствора перманганата калия (ЭДС›0)Cамым сильным восстановителем будет:
S +2H+ +2e =H2S Е=0,17 В,
∆Е=1,507-0,17=1,337 В
Слайд 17 МnО4- + 8Н+ +5е = Мn2++ 4 Н2О
в кислой
S042- +2Н+ +2е= S032- + Н2ОМnО4- + 2Н2О - 3е = MnO2 + 4OH- в нейтральной
S042- +2Н+ +2е= S032- + Н2О
МnО4-+е= МnО42- в щелочной
S042- +2Н+ +2е= S032- + Н2О
Выясните возможность протекания реакции между растворами перманганата калия и сульфита натрия в:
а) кислой, б) щелочной и в) нейтральной среде.
В какой среде окислительные свойства иона МпО4- выражены сильнее?
В какой среде наиболее энергичнее будет протекать реакция?
Слайд 18
Вывод:
а)МnО4- + 8Н+ +5е = Мn2++ 4
Н2О E=1,507 B
S042- +2Н+ +2е= S032- + Н2О Е=0,22 Вв кислой ∆Е=1,287 В
б)МnО4- + 2Н2О - 3е = MnO2 + 4OH- Е=0,60В
S042- +2Н+ +2е= S032- + Н2О Е=0,22 В
в нейтральной ∆Е=0,38 В
в)МпО4-+е= МпО42- Е=0,564
S042- +2Н+ +2е= S032- + Н2О Е=0,22 В
в щелочной ∆Е=0,344 В
Слайд 19
Все три реакции протекают самопроизвольно, т.к. ЭДС›0.
Окислительные свойства
иона МпО4- выражены сильнее в кислой среде, т.к. самый
высокий стандартный потенциал.В кислой среде наиболее энергичнее будет протекать реакция, т.к. самое большое значение ЭДС
Слайд 20 Опыт 3. Окислительные свойства перманганата калия. В три
отдельные пробирки с раствором перманганата калия добавьте разбавленную серную
кислоту, такой же объем воды и концентрированный раствор щелочи. Затем в каждую из пробирок прибавьте раствор сульфита натрия. Объясните наблюдаемое явление, имея в виду образованиев кислой среде ионов Mn2+ (слабо-розовая окраска),
в нейтральной среде- MnO2 (осадок бурого цвета)
щелочной среде - ионов MnO42- (зеленая окраска).
Слайд 21
2KMnO4 + H2O+3Na2SO3=
2MnO2↓ + 2K2SO4
+3Na2SO4+2KOHбурый
2KMnO4 +2 KOH+Na2SO3=
2K2MnO4+Na2SO4+H2O
зеленый р-р
2KMnO4 + 3H2 SO4+5Na2SO3=
2MnSO4 +K2SO4+5Na2SO4+3H2O
бесцветный р-р
Слайд 22 Опыт 4. Влияние среды на окислительно-восстановительный потенциал.
В две пробирки внесите дихромат калия (желтого цвета) и
внесите: в одну - раствор серной кислоты, в другую раствор щелочи. Изменение окраски раствора в одной пробирки на оранжевую обусловлено переходом CrO42-,устойчивого в щелочной среде, в ион Cr2O72-устойчивого в кислой среде. В каждую пробирку добавьте несколько капель нитрита калия. В обоих случаях изменилась окраска раствора? В какой среде произошло изменение степени окисления от +6 до +3 (зеленая окраска характерна для иона Сr3+). Объясните результаты опытов.Слайд 24 Cr2O7 2-+ 14H+ +6e = 2Cr3+ + 7H2O
E Cr2O72-/ Сr3+ = 1,33B
2J- -
2e → J20 EJ2 \2J-= 0,536 BЭДС›0
Наибольшая окислительная активность хроматов
проявляется в кислой среде, где они присутствуют в виде дихромат-ионов
K2Cr2O7 + 6KI + 7H2SO4 → 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
Слайд 25
2K2CrO4 + H2SO4=К2Cr2O7+ K2SO4 +H2O
K2Cr2O7+ 2KOH=2K2CrO4 + H2O
K2Cr2O7
+ 6KI + 7H2SO4 → 3I2 + Cr2(SO4)3 +
4K2SO4 + 7H2OВ кислой среде произошло изменение степени окисления от +6 до +3 (зеленая окраска характерна для иона Сr3+). Реакция протекает самопроизвольно, т.к. ЭДС›0
Слайд 26
Ограничено ли прогнозирование окислительно-восстановительных реакций?
Можно ли предсказать
точно, будет ли протекать реакция или нет?
Можно ли
«заставить» идти реакцию?Что можно еще изменить, чтобы изменить ход реакции?
Слайд 27
Реакция горения ацетилена:
С2Н2 + О2 = 5/2 СО2
+ Н2О + 1300 кДж
Картина «Вечерний проспект» современного
американского художника Томаса Кинкейда (Thomas Kinkade )
Почему сварка
ацетиленовая, а не
метановая или этановая?
Почему газовые
фонари в XIX веке были
ацетиленовые?
Слайд 28 Черный порох: +5
0 0
0 +4 -22 KNO3 + 3 C + S = N2 + 3 CO2 + K2S + 706,4 кДж
K2SO4, K2CO3, CO (другие продукты окисления)
Горение черного пороха изучалось Л.Н. Шишковым в 1857 году