- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Общая геохимия
Содержание
- 2. Положение Геохимии среди главных естественных наук
- 3. Вернадский Владимир Иванович (1863–1945)Русский минералог, кристаллограф, геолог, геохимик, историк и организатор науки, философ, общественный деятель.
- 4. ГЕОХИМИЯ – наука, изучающая химический состав Земли,
- 5. Поведение и формы нахождения химических элементов в
- 6. Изучение изоморфных смесей; типоморфизм минералов.Изучение геохимии отдельных
- 7. Геохимическая зональность.Законы дифференциации вещества Земли.Взаимодействие вещества мантии
- 8. Происхождение химических элементов.Рациональное (комплексное) использование земных ресурсов.Гипергенное
- 9. Методы исследования:Химические методыФизические методыГеологические методыМетоды составления диаграммМетодика
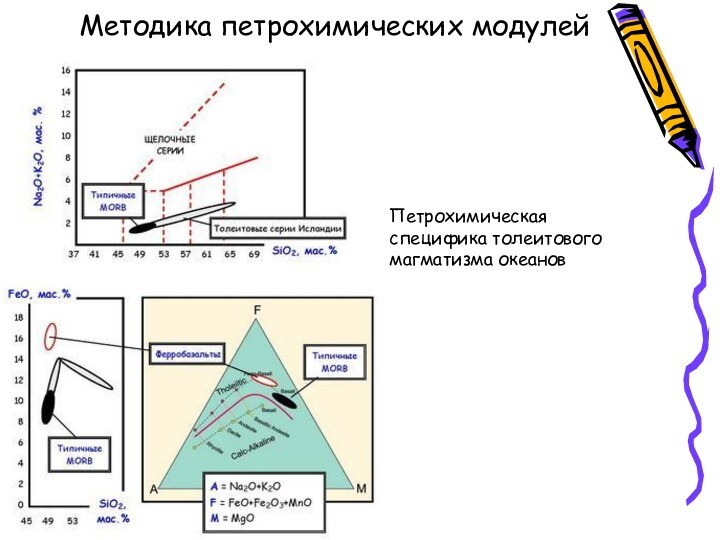
- 10. Методика петрохимических модулей Петрохимическая специфика толеитового магматизма океанов
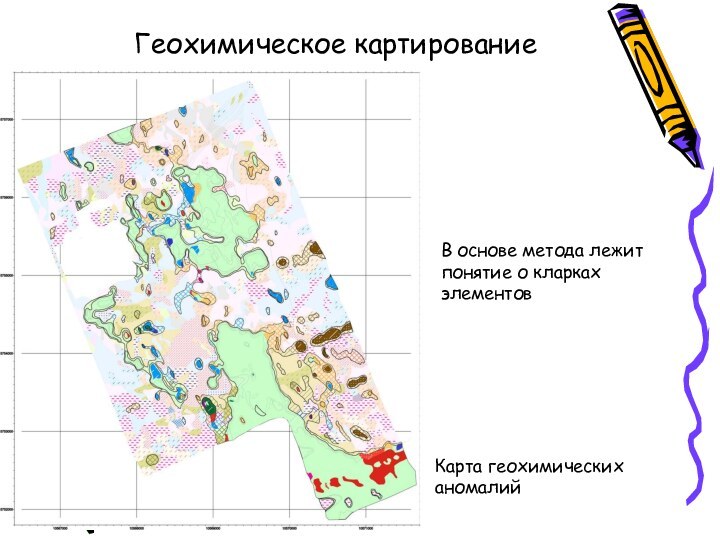
- 11. Геохимическое картированиеКарта геохимических аномалийВ основе метода лежит понятие о кларках элементов
- 12. Геохимические методы поисков месторождений полезных ископаемых Принципы
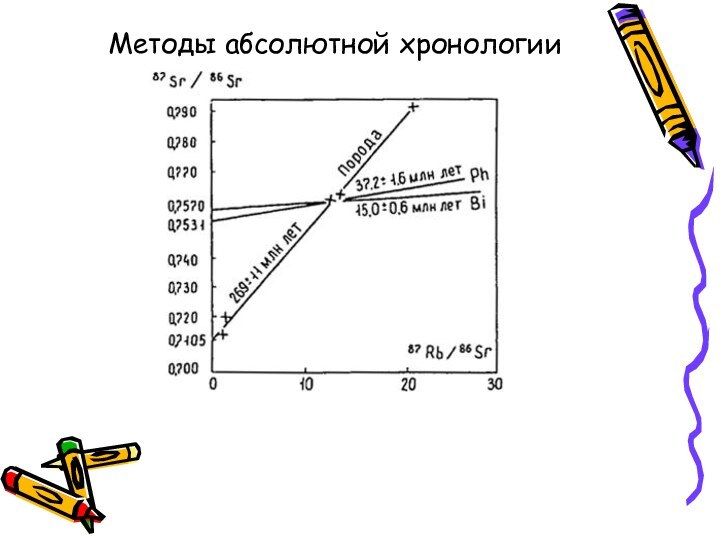
- 13. Методы абсолютной хронологии
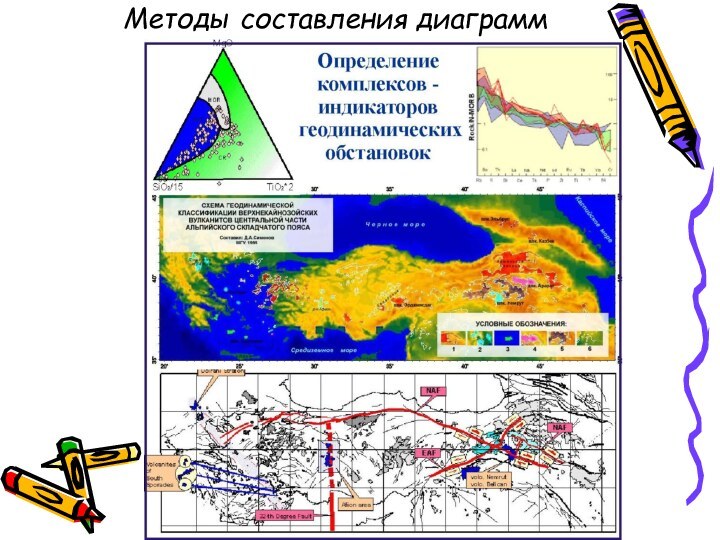
- 14. Методы составления диаграмм
- 15. Александр Евгеньевич Ферсман (1883 - 1945) –
- 16. 1. Физико-химические исследования процессов формирования минералов, горных
- 17. 2. Прикладная геохимияГеохимические методы поисков месторождений полезных
- 18. 3. Геохимия элементовОбъектом исследования является конкретный элемент,
- 19. Кристаллохимическое направление Расшифровка структур минералов, изоморфизм,
- 20. Химический состав природных геохимических системХимический элемент — совокупность
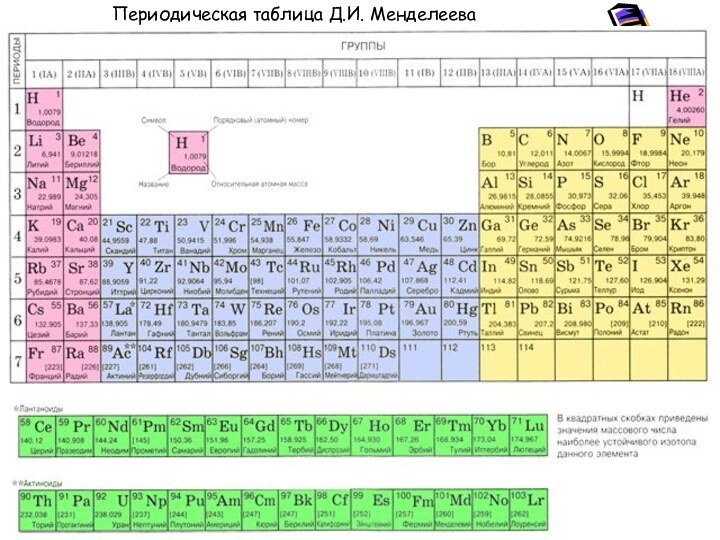
- 21. Периодическая таблица Д.И. Менделеева
- 22. Природные вещества могут состоять как из одного
- 23. Атом - это качественно своеобразная сложная материальная
- 25. «Нуклоны» - это мельчайшие частицы, способных к
- 26. Строение электронной оболочки Способность атомов вступать в
- 27. Принцип исключения (или запрета) Паули: в атоме
- 28. Основные моменты:главное квантовое число n определяет номер
- 29. на внешней (наружной) электронной оболочке, как уже
- 30. Элементы, которые имеют устойчивую 8-электронную оболочку, аналогичную
- 31. элементы, имеющие достроенный до 18 электронов предпоследний
- 32. элементы, у которых не полностью достроена подгруппа
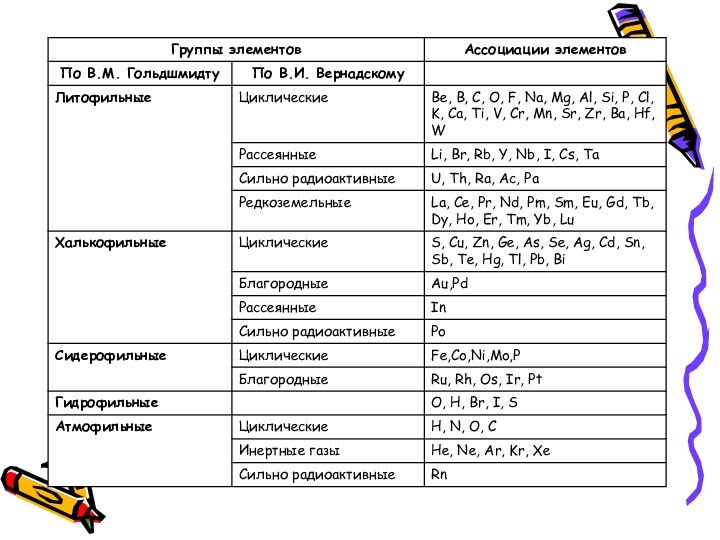
- 33. ГЕОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- 34. Геохимическая классификация В.М. Гольдшмидта Геохимическая классификация В.М.
- 35. Литофильные - это породообразующие элементы, имеющие 2-
- 36. Кривая атомных объемов (по А.И. Перельману): 1
- 37. Халькофильные - это элементы 18-электронного типа; характеризуются
- 38. Кривая атомных объемов (по А.И. Перельману): 1
- 39. Сидерофильные элементы дают переходные ионы 9 –
- 40. Кривая атомных объемов (по А.И. Перельману): 1
- 41. Атмофильные - это элементы, входящие в состав
- 42. Кривая атомных объемов (по А.И. Перельману): 1
- 43. Гидрофильные элементы - это наиболее характерные элементы
- 44. В основе классификации В.И. Вернадского лежат геохимические факты:
- 46. Группы элементов, используемые при геохимических исследованиях
- 47. Франк Уиглсуорт Кларк19 марта 1847- 23 мая 1931Представление
- 48. В 1924 г., когда Ф.В. Кларк совместно с
- 49. В 1923 г. А.Е. Ферсман предложил термин
- 50. Закон Кларка-Вернадского - Все элементы есть везде
- 51. Общие закономерности распространения элементов на Земле В
- 52. о - четные элементы; ∙ - нечетные
- 53. 2. Преобладают легкие атомы; средний атомный вес земной коры 17,25.
- 54. 3. По весовым кларкам наиболее распространенными элементами
- 55. 4. Кислород - абсолютно преобладающий элемент.5. После
- 56. 6. Очень легкие элементы (Be, С, N)
- 57. 7. Четные элементы распространены шире нечетных в
- 58. 8. Широко распространены элементы, атомный вес которых
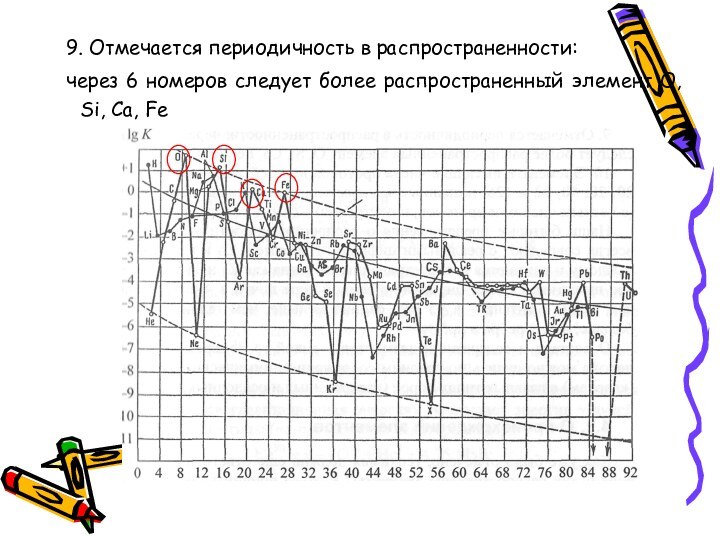
- 59. 9. Отмечается периодичность в распространенности:через 6 номеров следует более распространенный элемент О, Si, Ca, Fe
- 60. 10. Элементы, имеющие числа протонов или нейтронов,
- 61. Основной закон геохимии (В.М. Гольдшмидт) :Содержания химических
- 62. Скачать презентацию
- 63. Похожие презентации
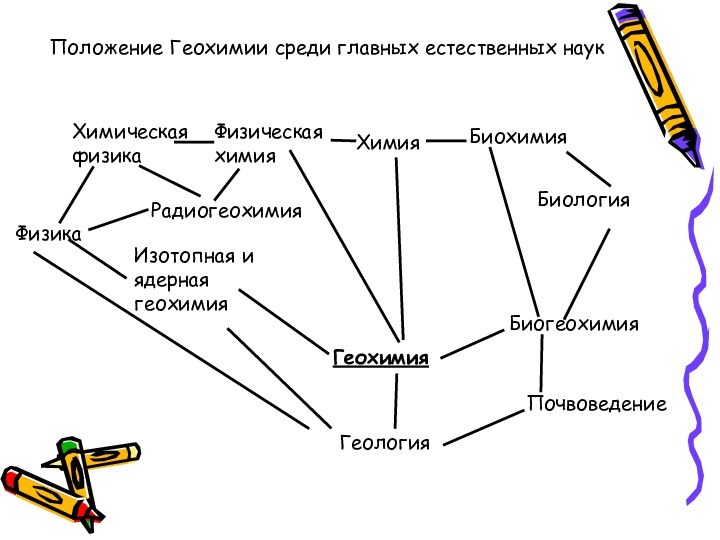
Положение Геохимии среди главных естественных наук















































Слайд 3
Вернадский Владимир Иванович (1863–1945)
Русский минералог, кристаллограф, геолог, геохимик,
историк и организатор науки, философ, общественный деятель.
Слайд 4 ГЕОХИМИЯ – наука, изучающая химический состав Земли, распространенность
в ней химических элементов и их стабильных изотопов, закономерности
распределения химических элементов в различных геосферах, законы поведения, сочетания и миграции (концентрации и рассеяния) элементов в природных процессах.Слайд 5 Поведение и формы нахождения химических элементов в различных
оболочках Земли (геосферах и при различных геологических процессах).
Условия и
закономерности миграции – концентрации (образование месторождений) и рассеяния химических элементов.Изучение изотопов химических элементов для решения вопросов о возрасте пород, источнике вещества, о палеотемпературах, решение генетических и других вопросов.
Задачи современной геохимии
Слайд 6
Изучение изоморфных смесей; типоморфизм минералов.
Изучение геохимии отдельных регионов
земной коры.
Дальнейшее повышение чувствительности и точности аналитических методов. Совершенствование
методик геохимических исследований.Изучение миграции химических элементов в связи с деятельностью человека.
Изучение космических объектов
Задачи современной геохимии
Слайд 7
Геохимическая зональность.
Законы дифференциации вещества Земли.
Взаимодействие вещества мантии и
коры. Геохимия мантии Земли.
Кинетика и динамика процессов (магматического, гидротермального
и др.).Химизм природных процессов минерало- и рудообразования; источники рудного вещества.
Поиски минерального сырья.
Проблемы современной геохимии
Слайд 8
Происхождение химических элементов.
Рациональное (комплексное) использование земных ресурсов.
Гипергенное минералообразование.
Геохимия
ноосферы.
Сохранение среды жизнеобитания.
Геохимия внутриматериковых вод.
Закономерности и механизмы осадкообразования.
Проблемы, возникшие
в связи с изучением космоса Проблемы современной геохимии
Слайд 9
Методы исследования:
Химические методы
Физические методы
Геологические методы
Методы составления диаграмм
Методика петрохимических
модулей
Геохимическое картирование
Геохимические методы поисков МПИ
Методы абсолютной геохронологии
Моделирование химических природных
процессов
Слайд 11
Геохимическое картирование
Карта геохимических аномалий
В основе метода лежит понятие
о кларках элементов
Слайд 12
Геохимические методы поисков месторождений полезных ископаемых
Принципы геохимических методов
поисков: особенности формирования ореолов, поисковые критерии и признаки (ассоциации
элементов, геохимические индикаторы K/Rb, Mg/Li, Zr/Hf, Al/Ga, Th/U, Ca/Sr и др., минералы-концентраторы).
Слайд 15
Александр Евгеньевич Ферсман (1883 - 1945) –
Дата
рождения:27 октября (8 ноября) 1883)
Место рождения:Санкт-Петербург
Научная сфера: геохимия, минералогия
Место работы: директор
Минералогического музея РАНАльма-матер:МГУ
Известен как: один из основателей геохимии
Награды и премии Премия имени В. И. Ленина (1929)
Слайд 16 1. Физико-химические исследования процессов формирования минералов, горных пород
и руд, земной коры и мантии.
Физическая геохимия -
включает изучение всех процессов (магматического, гидротермального и др.), с одной стороны, и физико-химическое моделирование процессов - с другой, задача науки - установление генезиса минералов, пород и руд Методы исследования : физико-химический анализ парагенезисов минералов; физико-химические расчеты; экспериментальное моделирование; физико-химическое теоретическое моделирование.
Основные направления в геохимии
Слайд 17
2. Прикладная геохимия
Геохимические методы поисков месторождений полезных ископаемых,
геохимические основы металлогении и прогноза, индикаторные свойства химических элементов
в геологических процессах, радиогеохронология, геохимия ноосферы, эволюция природных экосистем и др.Методы: литохимические, гидрогеохимические, атмохимические, биогеохимические; структурно-геохимический метод изучения околорудных метасоматитов.
Слайд 18
3. Геохимия элементов
Объектом исследования является конкретный элемент, его
поведение и миграция в разных процессах и системах (геохимия
редких элементов, геохимия газов).4. Гидрогеохимия, гидрогеология, геохимия океана.
Основные вопросы и проблемы: закономерности формирования термальных вод, установление баланса основных компонентов океана (Na, Mg, К, Cl, S и др.); происхождение вод океана и растворенных в нем веществ, эволюция океана; происхождение и геохимическая деятельность подземных вод; сохранение качества и ресурсов пресной воды.
Слайд 19
Кристаллохимическое направление
Расшифровка структур минералов, изоморфизм, типоморфизм,
энергия кристаллических построек. Совершенствование методов и методик исследования: рентгено-структурный
и химический анализы, минералотермометрия, газово-жидкие включения и др.6. Направление, связанное с новыми объектами
Глубинное бурение, космические объекты.
Слайд 20
Химический состав природных геохимических систем
Химический элемент — совокупность однотипных
атомов, имеющих единый атомный номер в таблице Д.И. Менделеева,
обладающие определенными химическими и физическими свойствами.Химический элемент – множество атомов с одинаковым зарядом ядра, числом протонов, совпадающим с порядковым или атомным номером в таблице Д.И. Менделеева.
Слайд 22 Природные вещества могут состоять как из одного химического
элемента (простое веществ), так и из разных (сложное веществ
или химическое соединение, сложные природные системы ).Слайд 23 Атом - это качественно своеобразная сложная материальная микросистема,
обладающая индивидуальностью, но изменчивая, способная к превращениям.
Элементарные частицы
и строение атомаСтроение ядра
Слайд 25 «Нуклоны» - это мельчайшие частицы, способных к взаимопревращениям.
Атомные ядра состоят из элементарных частиц – протонов (p)
и нейтронов (n).Мp = 1,67239×10-24 г
Mn = 1,67470×10-24 г
Массовое число (A) – общее число нуклонов в ядре
A=Z+N
Z – число протонов в ядре
N – число нейтронов в ядре
Слайд 26
Строение электронной оболочки
Способность атомов вступать в соединения,
образовывать минералы определяется свойствами электронов, их энергетическим состоянием, которое
характеризуется квантовыми числами дискретной природы.
Слайд 27
Принцип исключения (или запрета) Паули:
в атоме не
может быть двух электронов с одинаковыми четырьмя квантовыми числами.
Слайд 28
Основные моменты:
главное квантовое число n определяет номер периода,
который включает ряд элементов, имеющих разное количество электронов на
внешних слоях;в группах или рядах таблицы элементы различаются только величиной n, т.е. количеством квантовых слоев (орбит), количество же электронов на внешнем слое одинаковое и соответствует номеру группы;
Слайд 29 на внешней (наружной) электронной оболочке, как уже указывалось,
может находиться 2n2 электронов, т.е. 2, 8, 18 и
т.д.Слайд 30 Элементы, которые имеют устойчивую 8-электронную оболочку, аналогичную внешнему
слою инертных газов, названы элементами типа благородных газов или
элементами 8-электронного типа.Это элементы s и р подгрупп, составляющие 95% всей массы земной коры, породообразующие (петрогенные) элементы: Na, К, Mg, Ca, Al, Si, Ва и др.;
Слайд 31 элементы, имеющие достроенный до 18 электронов предпоследний слой,
называют элементами 18-электронного типа, а в геохимии - типа
купро.Это элементы, следующие после достройки подгруппы d электронов в (n - 1) слое, т.е. некоторые d- и p-элементы: Сu, Zn, Ga, Ge, As, Ag, Cd, In, Sn, Аu, Hg, Tl, Pb, Bi;
Слайд 32 элементы, у которых не полностью достроена подгруппа (n-1)d
предпоследнего слоя подгруппы (n-2)f третьего снаружи слоя (n-2), названы
промежуточными переходными элементами: Sc, Ti, V, Cr, Mn, Fe, Ni, Co.
Слайд 34
Геохимическая классификация В.М. Гольдшмидта
Геохимическая классификация В.М. Гольдшмидта
учитывает электронное строение атомов, положение элемента на кривой атомных
объемов (отношение атомного веса к удельному весу), магнитные свойства элементов (влияние третьего квантового числа) и химическое сродство прежде всего к О и S, затем к As и другим элементам.Все химические элементы разделены им на пять геохимических групп: литофильные, халькофильные, сидерофильные, биофильные, атмофильные.
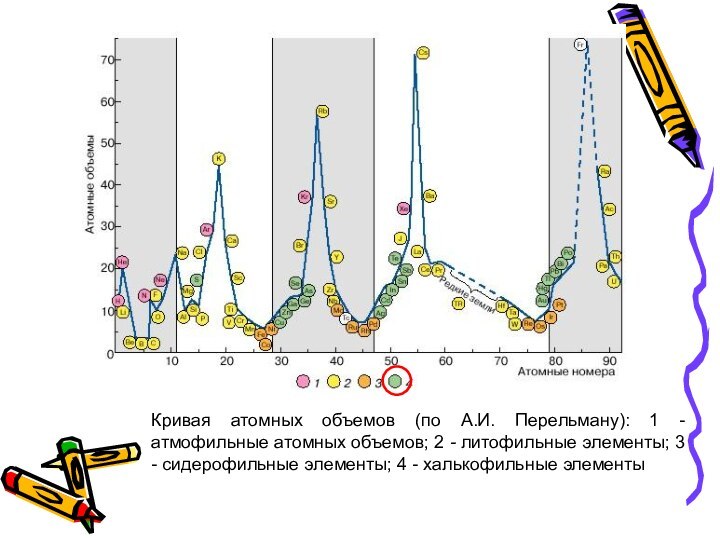
Слайд 35 Литофильные - это породообразующие элементы, имеющие 2- и
8-электронную достроенную оболочку по типу инертного газа; характеризуются сродством
к кислороду (ионные связи), т.е. образуют преимущественно кислородные соединения (оксиды, гидрооксиды, силикаты, фосфаты и др.); элементы парамагнитные.На кривой атомных объемов (по Перельману) располагаются на верхних пиках и на нисходящих участках кривой атомных объемов
Слайд 36 Кривая атомных объемов (по А.И. Перельману): 1 -
атмофильные атомных объемов; 2 - литофильные элементы; 3 -
сидерофильные элементы; 4 - халькофильные элементы
Слайд 37 Халькофильные - это элементы 18-электронного типа; характеризуются сродством
к сере (к Se, Те-элементам 8-электронного типа), т.е. образуют
сульфиды, селениды, теллуриды, благодаря ковалентной связи; диамагнетики. Многие из них встречаются в самородном виде.На кривой атомных объемов располагаются на восходящих участках кривой атомных объемов.
Слайд 38 Кривая атомных объемов (по А.И. Перельману): 1 -
атмофильные атомных объемов; 2 - литофильные элементы; 3 -
сидерофильные элементы; 4 - халькофильные элементы
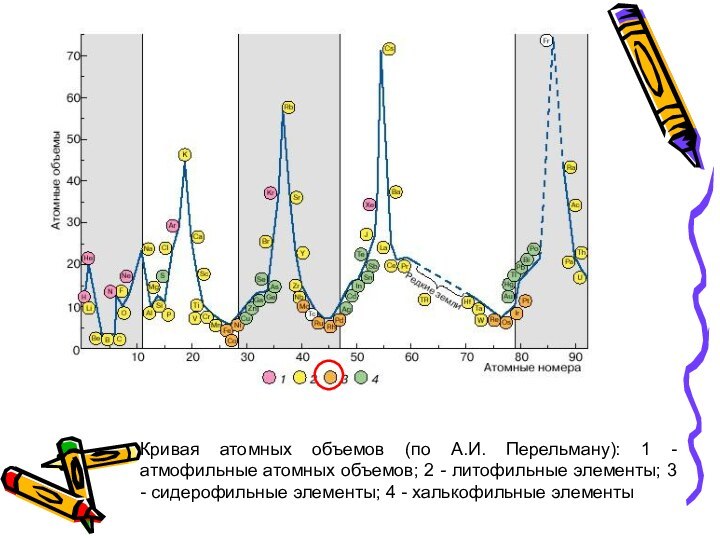
Слайд 39 Сидерофильные элементы дают переходные ионы 9 – 17-электронной
конфигурации на внешнем слое; обнаруживают сродство как к кислороду
(ионные связи), так и к сере (ковалентные связи), образуют сульфиды (пирит, арсенопирит и др.), оксиды (магнетит, гематит, ильменит и др.), силикаты (пироксены, амфиболы, слюды и др.). Отмечается сродство к мышьяку (никелин, смальтин и др.).Это ферромагнитные и парамагнитные элементы. Некоторые встречаются в самородном состоянии.
Имеют очень малые атомные объемы и занимают низкие места на кривой атомных объемов.
Слайд 40 Кривая атомных объемов (по А.И. Перельману): 1 -
атмофильные атомных объемов; 2 - литофильные элементы; 3 -
сидерофильные элементы; 4 - халькофильные элементы
Слайд 41 Атмофильные - это элементы, входящие в состав атмосферы:
инертные газы (8-электронного типа), N, и Н.
На кривой
атомных объемов занимают восходящие участки; с трудом вступают в соединения (кроме Н) и находятся в элементарном состоянии.Диамагнитны.
Слайд 42 Кривая атомных объемов (по А.И. Перельману): 1 -
атмофильные атомных объемов; 2 – литофильные элементы; 3 -
сидерофильныеэлементы; 4 - халькофильные элементы
Слайд 43 Гидрофильные элементы - это наиболее характерные элементы для
гидросферы.
Некоторые элементы могут относиться к разным группам, что связано
с их способностью вступать в соединение с кислородом, серой или другими элементами. Слайд 44 В основе классификации В.И. Вернадского лежат геохимические факты: история
химических элементов в земной коре, форма нахождения элементов, явления
радиоактивности, обратимость или необратимость миграции (цикличность) элементов, способность элементов образовывать минералы, состоящие из нескольких разнородных атомов.Им выделено 6 групп.
Геохимическая классификация В.И. Вернадского
Слайд 47
Франк Уиглсуорт Кларк
19 марта 1847- 23 мая 1931
Представление о
распространенности химических элементов в природе и понятие о кларке
Слайд 48 В 1924 г., когда Ф.В. Кларк совместно с Г.С. Вашингтоном
опубликовал таблицу распространенности 50 химических элементов.
Распространенность элементов была
пересчитана на 100 % за вычетом воды и малых компонентов и в пересчете на окислы:
Слайд 49
В 1923 г. А.Е. Ферсман предложил термин кларк
Кларк
– среднее содержание химических элементов в земной коре, гидросфере,
Земле в целом, космических телах и др. геохимических или космохимических системах
Слайд 50
Закон Кларка-Вернадского
- Все элементы есть везде и
всюду
- Для всех химических элементов характерно повсеместное распространение
во всех геосферахВ.И. Вернадский ещё в 1909 г писал: «В каждой капле и пылинке вещества на земной поверхности, по мере увеличения тонкости наших исследований, мы открываем все новые и новые элементы. Получается впечатление микрокосмического их рассеяния. В песчинке или капле, как в микрокосмосе, отражается общий состав космоса».
Слайд 51
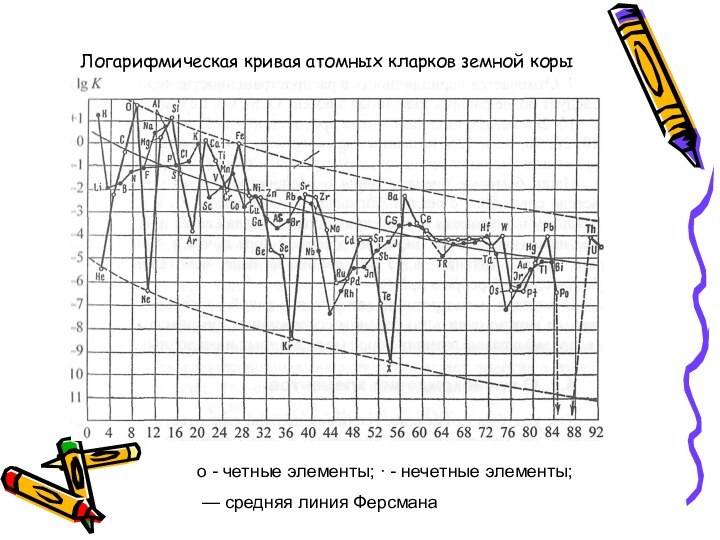
Общие закономерности распространения элементов на Земле
В
целом распространенность элементов падает от начала к концу таблицы
Менделеева, но не плавно, а скачками с «пиками» и «провалами».
Слайд 52
о - четные элементы; ∙ - нечетные элементы;
— средняя линия Ферсмана
Логарифмическая кривая атомных кларков земной
корыСлайд 54 3. По весовым кларкам наиболее распространенными элементами земной
коры являются следующие (по А.Е. Ферсману):
O - 49,13, Si
-26,00, Al-7,45, Fe – 4,2, Ca- 3,25, Na – 2,4, K – 2,35, Mg – 2,35, H – 1,00,
Ti – 0,61, C – 0,35, Cl – 0,20, P – 0,12, S – 0,10, Mn – 0,10,
F – 0,08, Ba – 0,05, N – 0,04, Sr – 0,035, Cr – 0,030,
Zr – 0,025, V – 0,020, Ni – 0,020, Zn – 0,020, Cu – 0,010
Слайд 55
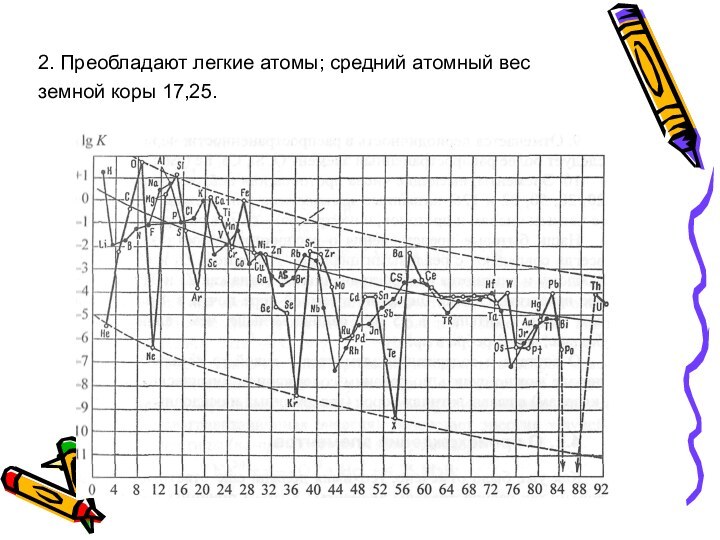
4. Кислород - абсолютно преобладающий элемент.
5. После Fe
(№ 26) нет ни одного широко распространенного элемента; с
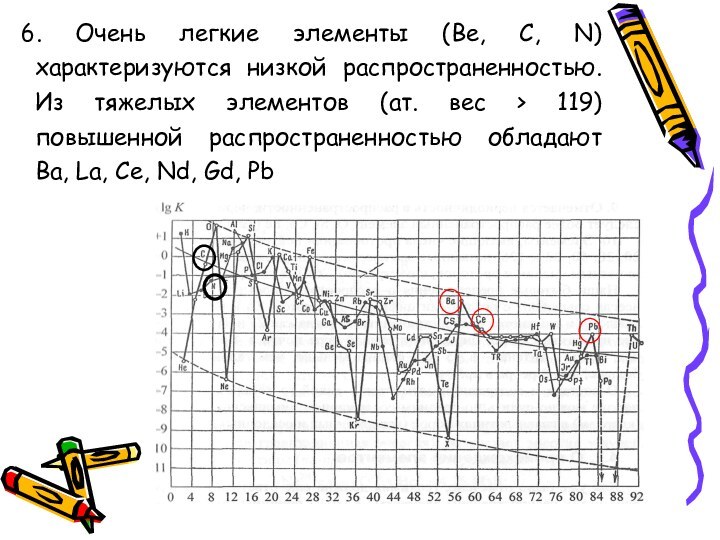
Cu (№ 29) начинается «область малых величин».Слайд 56 6. Очень легкие элементы (Be, С, N) характеризуются
низкой распространенностью. Из тяжелых элементов (ат. вес > 119)
повышенной распространенностью обладают Ва, La, Ce, Nd, Gd, PbСлайд 57 7. Четные элементы распространены шире нечетных в 5
– 10 раз (закон Оддо–Гаркинса).
Для первых по распространенности 9
элементов:весовые кларки четных элементов (О, Si, Fe, Ca, Mg) - 85,54 %;
весовые кларки нечетных элементов (Аl, К, Na, H) - 13,02 %.
Слайд 58 8. Широко распространены элементы, атомный вес которых делится
на 4 без остатка (гелио группы) – закон Ферсмана
кратности четырем.Такие элементы (О, Si, Ca, Mg, Ti и др.) названы им элементами 4q, где q – целое число
Слайд 59
9. Отмечается периодичность в распространенности:
через 6 номеров следует
более распространенный элемент О, Si, Ca, Fe
Слайд 60 10. Элементы, имеющие числа протонов или нейтронов, равные
2, 8, 20, 28, 50, 82 и 126, названные
магическими или дважды магическими (с четным числом и протонов, и нейтронов) – самые распространенные.Наиболее устойчивы дважды магические ядра, содержащие магическое число и протонов и нейтронов – 4He, 16O, 40Ca. В земной коре элементы с магическими ядрами обладают достаточно высокой распространенностью (за исключением гелия).