Слайд 2
Цели урока:
1) Образовательные: сформировать у учащихся понятие о гидролизе
солей, научить
составлять уравнения реакций гидролиза различных солей. Углубить знания
учащихся
об обратимых химических реакциях. Закрепить практические навыки
определения среды раствора. Совершенствовать умения в работе с тестовыми
заданиями разных типов.
2) Развивающие: развивать у учащихся умения сравнивать и анализировать теоретические сведения, применять их на практике, делать выводы; выделять главное в процессе демонстрации опыта, развивать логическое мышление.
3) Воспитательные: формировать материалистическое представление об окружающем мире, воспитывать осознанное представление о химии как производительной силе общества, воспитывать чувство ответственности за сохранение окружающей среды.
Слайд 3
Задачи:
Совершенствовать умение работать с учебным материалом, научить составлять
уравнения гидролиза в молекулярном и ионном виде.
Сравнивать состав и
свойства солей, прогнозировать реакцию среды раствора соли на основе анализа её состава, уметь строить аналогию и самостоятельно делать выводы по результатам проведенных опытов.
Сформировать понимание практического значения гидролиза в природе и жизни человека.
Слайд 4
«Повторение основных важнейших опорных знаний»
Дать определения :
-ЭЛЕКТРОЛИТЫ
НЕЭЛЕКТРОЛИТЫ
-Электролитическая диссоциация
Определение
солей в свете теории электролитической диссоциации.
Слайд 5
Изучение нового материала
Гидролиз солей - это химическое взаимодействие ионов
соли с ионами воды, приводящее к образованию слабого электролита.
Гидролиз
в переводе с греческого « разложение водой»
Процесс гидролиза может быть обратимым и необратимым
Слайд 6
Запомни!
К обратимому гидролизу относится гидролиз солей, в которых
есть « сильный» компонент , к необратимым - нет
« сильного» компонента.
Слайд 7
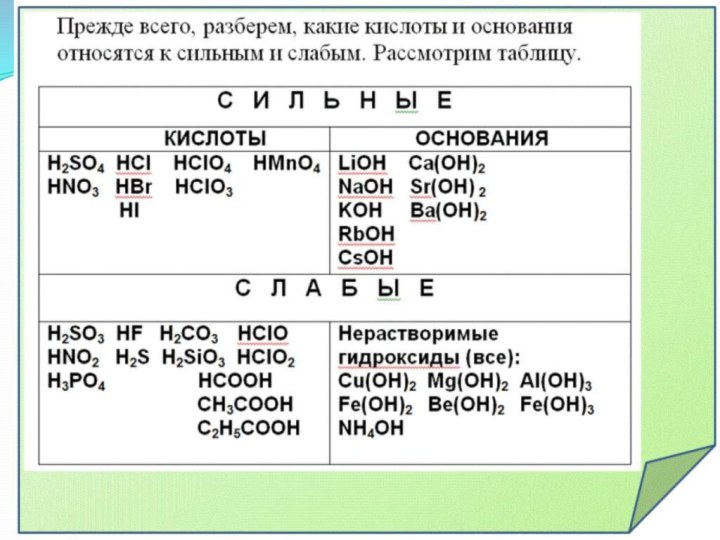
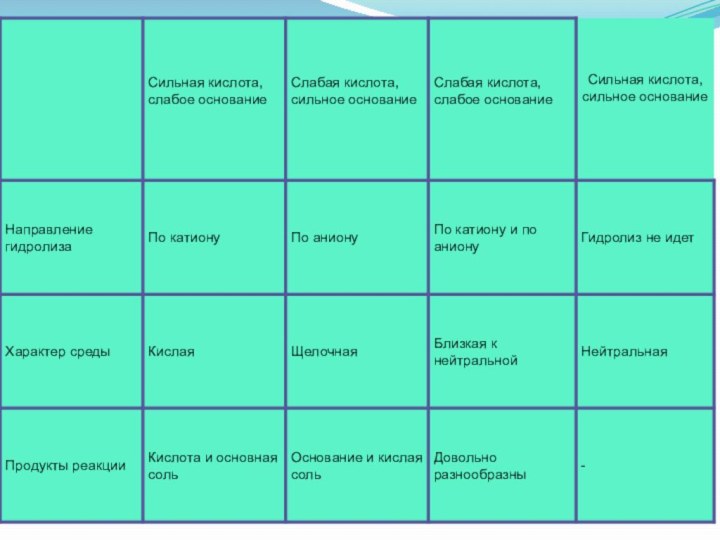
4 ТИПА СОЛЕЙ:
соль, образованная сильной кислотой и
слабым основанием (ALCl3);
сильным основанием и слабой кислотой (Na2
S);
сильным основанием и сильной кислотой (NaCl);
слабым основанием и слабой кислотой (СН3СООNH4).
Слайд 8
1). Гидролиз не возможен
Соль, образованная сильным основанием и сильной
кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в
этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
Слайд 9
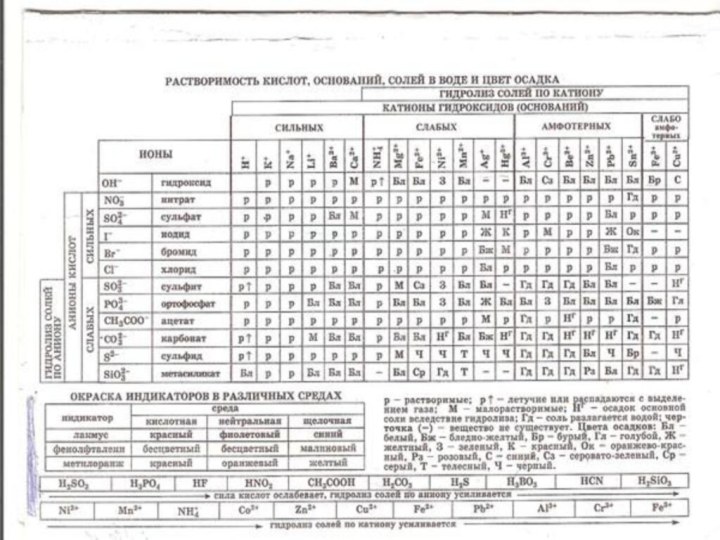
2). Гидролиз по катиону (в реакцию с водой вступает
только катион)
В соли, образованной слабым основанием и сильной кислотой
(FeCl2, NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион:
FeCl2 + HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- <=> FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H+ и другие ионы.
рН раствора < 7 (раствор приобретает кислую реакцию).
Слайд 10
3). Гидролиз по аниону (в реакцию с водой вступает
только анион)
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3,CH3COONa)
подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
K2SiO3 + НОH =>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH- => НSiO3- + 2K+ + ОН-
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
Слайд 11
ВЫВОД
По аниону соли, как правило , гидролизуются обратимо;
Химическое
равновесие смещено влево;
Реакция среды щелочная (рН 7)
При
гидролизе солей , образованных слабыми многоосновными кислотами , получаются кислые соли.
Слайд 12
Соль, образованная слабым основанием и слабой кислотой ( СН3СООNН4, (NН4)2СО3, Al2S3),
гидролизуется и по катиону, и по аниону.
В результате
образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Аl2S3 + 6HOH =>2Аl(ОН)3 + 3Н2S
2Al3+ + 3S2- + 6H+ + 6OH- =>2Аl(ОН)3 +6Н+ + S2-
рН =7
Слайд 18
Гидролиз многокислотных солей и многоосновных кислот проходит ступенчато
Например,
гидролиз хлорида железа (II) включает две ступени:
1-ая ступень FeCl2 + HOH =>Fe(OH)Cl
+ HCl
Fe2+ + 2Cl- + H+ + OH- =>Fe(OH)+ + 2Cl- + H+
2-ая ступень Fe(OH)Cl + HOH =>Fe(OH)2 + HCl
Fe(OH)+ + Cl- + H+ + OH- =>Fe(ОН)2 + Н+ + Cl-
Слайд 19
Гидролиз карбоната натрия включает две ступени:
1-ая ступень Nа2СО3 + HOH
=>NаНСО3 + NаОН
СО32- + 2Na+ + H+ + OH- =>НСО3- + ОН- + 2Na+
2-ая ступень NаНСО3 + Н2О =>NаОН +
Н2СО3
НСО3- + Na+ + H+ + OH- =>Н2СО3 + ОН- + Na+
Слайд 20
Алгоритм составления уравнений гидролиза солей
Слайд 22
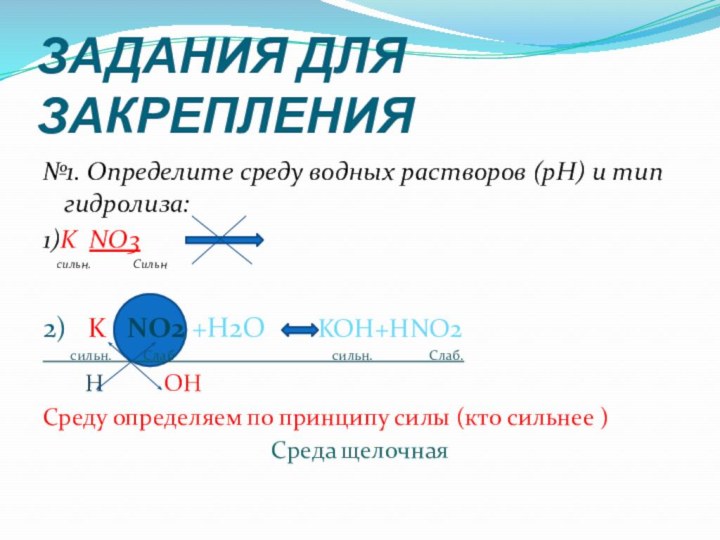
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Определите среду водных растворов (рН) и
тип гидролиза:
1)K NO3
сильн.
Сильн
2) K NO2 +H2O KOH+HNO2
сильн. Слаб сильн. Слаб.
Н ОН
Среду определяем по принципу силы (кто сильнее )
Среда щелочная
Слайд 23
Задание 3
Сu CI2+2HOH Cu(OH)2+2HCI
слаб. сильн
слаб сильн
Среда по принципу силы КИСЛАЯ
Слайд 24
Задания
4. Соль NaNO3 образована сильной кислотой (HNO3) и
сильным основанием (NaOH). Гидролиз не идет, новых соединений не
образуется, кислотность среды не изменяется.
5. Соль NiSO4 образована сильной кислотой (H2SO4) и слабым основанием (Ni(OH)2). Идет гидролиз по катиону, в ходе реакции образуются кислота и основная соль.
6. Карбонат калия образован слабой кислотой (H2CO3) и сильным основанием (KOH). Гидролиз по аниону, образование щелочи и кислой соли. Щелочная среда раствора.
7. Сульфид алюминия образован слабой кислотой (H2S) и слабым основанием (Al(OH)3). Идет гидролиз как по катиону, так и по аниону. Необратимая реакция. В ходе процесса образуются H2S и гидроксид алюминия. Кислотность среды меняется в незначительной степени.
Слайд 25
Задание 8
Сравните реакцию среды в растворах солей, не
проводя вычислений: а) Na2SO4; б) Na2SO3; в) Na2CO3.
Слайд 26
Решение
а) Соль Na2SO4 – сульфат натрия, образована сильной кислотой
(серной – H2SO4) и сильным основанием (гидроксидом натрия –
NaOH). Гидролизу подвергаются соли, содержащие слабый ион. Поскольку в этом соединении его нет, гидролиза не происходит и среда будет нейтральная.
Слайд 27
решение
б) Соль Na2SO3 – сульфат натрия, образована слабой кислотой
(сернистой – H2SO3) и сильным основанием (гидроксидом натрия –
NaOH). Гидролизу подвергаются соли, содержащие слабый ион. В этом соединении им является сульфит-анион, следовательно, среда будет щелочная.
Слайд 28
решение
в) Соль Na2CO3 – сульфат натрия, образована слабой кислотой
(угольной – H2СO3) и сильным основанием (гидроксидом натрия –
NaOH). Гидролизу подвергаются соли, содержащие слабый ион. В этом соединении им является карбонат-анион, следовательно, среда будет щелочная.
Слайд 29
Задание
Напишите уравнение гидролиза соли (NH4)2SO4, укажите реакцию среды
в растворе.
Решение
Сначала запишем уравнения диссоциации соли и воды:(NH4)2SO4 ↔ 2NH4+ +
SO42-.
H2O ↔ H+ + OH—.
Выясним слабый ион. Сульфат натрия – соль, образованная сильной кислотой – серной (H2SO4) и слабым основанием – гидроксидом аммония (NH4OH). Следовательно, протекает гидролиз по катиону:
2NH4+ + SO42- + 2H+ + 2OH— ↔ 2NH4OH + H2SO4.
(NH4)2SO4 + 2H2O ↔2NH4OH + H2SO4.
Наличие в растворе ионов водорода свидетельствует о том, что среда кислая.
Слайд 30
Установите соответствие между формулой соли и отношением её
к гидролизу.
Слайд 31
Задание
Какие из солей подвергаются гидролизу: KCl, K2S,
ZnCl2, Pb(NO3)2, Ca3(PO4)2, LiNO2, CsSiO3, AlBr3, Na2SO4?(Как вы это
определили?)( красным самостоятельно)
Запишите уравнения реакций гидролиза в ионном и молекулярном виде . Укажите среду растворов и окраску лакмусов в них
Слайд 32
Решение
- соль сильного основания - KOH, и сильной
кислоты - HCl - гидролизу не подвергается.
K2S- соль
сильного основания - KOH, и слабой кислоты –H2S Гидролиз пойдет по аниону -
1 – ступень
Гидроксид - анионы говорят нам о том, что среда - щелочная - лакмус синий
Слайд 33
Молекулярный Вид:
2 - ступень:
- снова щелочная среда, лакмус
- синий
Молекулярный вид:
Слайд 34
Подведение итогов . Выставление оценок
Урок я усвоил на
:
Я знаю
Я умею
Мне было интересно
Вызвало трудности
Слайд 35
Домашнее задание
Параграф 21 стр.93
Задача 1. Составьте молекулярные и ионные
уравнения гидролиза солей Li3PO4, KCl, CuCl2. Какое значение рН (рН ≥7, рН
≤ 7) имеют растворы этих солей?
Слайд 36
Решение
Li3PO4 – соль, образованная сильным основанием и слабой кислотой, гидролиз
по аниону
Li3PO4 ↔ 3Li+ + PO43-
I ступеньPO43- + HOH = HPO42- + OH—, pH > 7
Li3PO4 +
HOH = Li2HPO4+ LiOH
II ступеньHPO42- + HOH = H2PO4— + OH—, pH > 7
Li2HPO4+ HOH = LiH2PO4 + LiOH
III ступеньH2PO4— + HOH = H3PO4 + OH—, pH > 7
LiH2PO4+ HOH = H3PO4 + LiOH
Слайд 37
Решение
KCl – соль, образованная сильным основанием и сильной кислотой, гидролизу
не подвергается, рН ≈ 7
CuCl2 — соль, образованная слабым основанием и
сильной кислотой, гидролиз по катиону
CuCl2 ↔ Cu2+ + 2Cl—
I ступеньCu2+ + HOH ↔ (CuOH)+ + H+, pH<7
CuCl2 + HOH ↔ (CuOH)Cl + HCl
II ступень(CuOH)+ + HOH ↔ Cu(OH)2 + H+, pH<7
(CuOH)Cl + HOH↔ Cu(OH)2 + HCl