- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Обучающая программа по химии
Содержание
- 2. Обучающая программа для 8 класса
- 3. Биография Д. И. МенделееваКлассификация химических элементов до Д. И. МенделееваПериодический закон и Периодическая система химических элементовВыход
- 4. Д. И. Менделеев родился
- 5. Биография Д. И. МенделееваВернувшись в Петербург, Менделеев
- 6. Биография Д. И. Менделееваэлементов, в том числе
- 7. Биография Д. И. МенделееваВысказал в 1877 г.
- 8. Биография Д. И. Менделеева20 января 1907 г.
- 9. Вопрос №1 Б) 27 января 1834 года
- 10. Молодец!
- 11. Вопрос №2В) Изготовление чемоданов и рамок для
- 12. Молодец!
- 13. Вопрос №3А) Петербургский Главный педагогический институтВ) Московский Технологический институтБ) Казанский университетКакое высшее учебное заведение окончил Д.И.Менделеев?
- 14. Молодец!
- 15. Вернись обратно
- 16. Вопрос №4 А) «Органическая химия» Б)
- 17. Молодец!
- 18. Вопрос №5Б) Периодический закон химических элементовА) Закон
- 19. Молодец!
- 20. Вопрос №6А) «экаалюминия», «экабора», «экасилиция»Б) «экаалюминия», «экасилиция»,
- 21. Молодец!
- 22. Вопрос №7А) «О соединении спирта с водой»Б)
- 23. Молодец!
- 24. Вопрос №8В) А. А. Байков, А. Е.
- 25. Молодец!
- 26. Вопрос №9 В) Город Менделеевск в Ростовской
- 27. Молодец!
- 28. Вопрос №10Б) А) В) Укажите формулу состояния идеального газа, которое вывел Д. И. Менделеев?
- 29. Молодец!
- 30. Вопрос №11Б) За изготовление бездымного пороха А)
- 31. Молодец!
- 32. Вопрос №12В) В Одессе А) На
- 33. Молодец!
- 34. Молодец!Ты ответил на все вопросы данного раздела правильно!
- 35. Вернись обратно
- 36. Многие учёные до Д. И. Менделеева предприняли
- 37. образуемых им веществ так, чтобы величина, которую
- 38. цилиндра по линии, исходящей из его основания
- 39. возрастания атомных масс, присвоил химическим элементам соответствующий
- 40. Классификация химических элементов до Д. И. Менделеева
- 41. Классификация химических элементов до Д. И. МенделееваКлассификация
- 42. Вопрос №1Кто установил закон триад? А) Иоганн Вольф Дёберейнер Б) Джон Ньюлендс В) Бегье де Шанкуртуа
- 43. Молодец!
- 44. Вопрос №2Английский химик Д. Ньюлендс (1863 г.),
- 45. Молодец!
- 46. Вопрос №3Почему попытки классификации химических элементов до
- 47. Молодец!
- 48. Вопрос №4Как классифицировал химические элементы А. Бегье
- 49. Молодец!
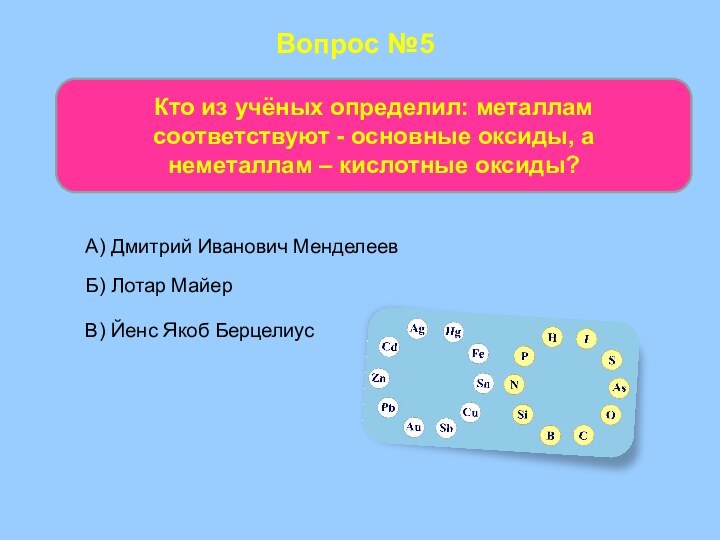
- 50. Вопрос №5Кто из учёных определил: металлам соответствуют
- 51. Молодец!
- 52. Вопрос №6Чему равна относительная атомная масса Sr
- 53. Молодец!
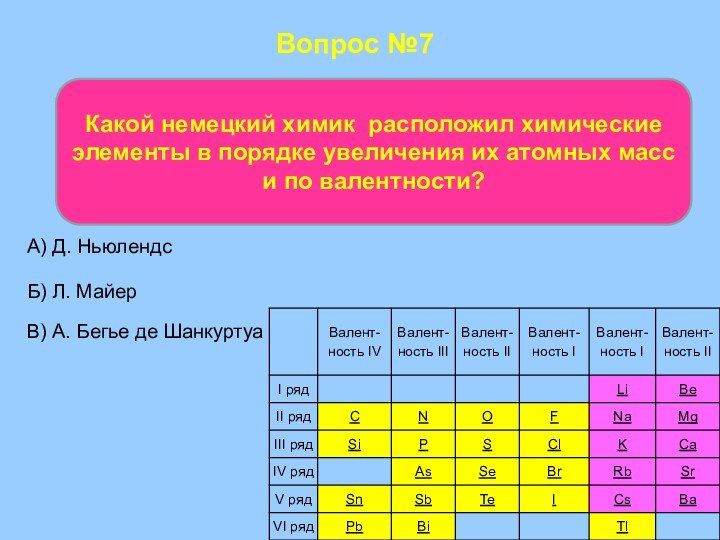
- 54. Вопрос №7Какой немецкий химик расположил химические элементы
- 55. Молодец!
- 56. Вопрос №8Сколько было известно химических элементов ко
- 57. Молодец!
- 58. Вопрос №9Какие химические элементы относятся к халькогенам?А)
- 59. Молодец!
- 60. Вопрос №10Са, Sr, Ba – это….А) Благородные газы В) Галогены Б) Щелочноземельные металлы
- 61. Молодец!
- 62. Вопрос №11Общая формула высших оксидов щелочноземельных металлов…А) R2O В) RO3 Б) RO
- 63. Молодец!
- 64. Вопрос №12Общее свойство галогеновБ) с металлами образуют соли В) «рождающие руды» А) не образуют химических соединений
- 65. Молодец!
- 66. Молодец!Ты ответил на все вопросы данного раздела правильно!
- 67. Вернись обратно
- 68. В отличие от учёных - предшественников,
- 69. Периодический закон и Периодическая система химических элементов
- 70. Периодический закон и Периодическая система химических элементовСтруктура
- 71. Периодический закон и Периодическая система химических элементовВажнейшей
- 72. Периодический закон и Периодическая система химических элементовЧисло
- 73. Периодический закон и Периодическая система химических элементовИзменение
- 74. Периодический закон и Периодическая система химических элементовII.
- 75. Способность атомов притягивать валентные электроны других атомов
- 76. Кроме горизонтальной, по периодам, периодичности в системе
- 77. Значение Периодического закона - Его открытие дало
- 78. Периодический закон и Периодическая система химических элементовВопросы345671211131517910121416818192021
- 79. Вопрос №1Что положил в основу классификации химических
- 80. Молодец!
- 81. Вопрос №2Элементы, которые размещены в четвёртой группе
- 82. Молодец!
- 83. Вопрос №3Кислотный характер соединений в ряду BeO
- 84. Молодец!
- 85. Вопрос №4Какое свойство характерно для всех химических элементов?А) Металлические свойства В) ВалентностьБ) Кислотные свойства
- 86. Молодец!
- 87. Вопрос №5Какова авторская формулировка Периодического закона Д.
- 88. Молодец!
- 89. Вопрос №6Группа – это…А) горизонтальный ряд химических
- 90. Молодец!
- 91. Вопрос №7Период – это…А) горизонтальный ряд химических
- 92. Молодец!
- 93. Вопрос №8Химические элементы B, C, N, O,
- 94. Молодец!
- 95. Вопрос №9В какой паре элементов наиболее выражены
- 96. Молодец!
- 97. Вопрос №10Какую валентность имеет хлор в оксиде Cl2O7 ?В) VБ) IIА) VII
- 98. Молодец!
- 99. Вопрос №11В побочные группы Периодической системы входят
- 100. Молодец!
- 101. Вопрос №12Укажите формулу элемента, атом которого имеет наибольшее число электроновА) BБ) NВ) Cl
- 102. Молодец!
- 103. Вопрос №13Разновидности атомов одного и того же
- 104. Молодец!
- 105. Вопрос №14Сколько электронов, протонов и нейтронов содержится
- 106. Молодец!
- 107. Вопрос №15От кислотных к основным меняются свойства
- 108. Молодец!
- 109. Вопрос №16В ряду химических элементов P –
- 110. Молодец!
- 111. Вопрос №17В ряду химических элементов K –
- 112. Молодец!
- 113. Вопрос №18Благодаря открытию Периодического закона и Периодической
- 114. Молодец!
- 115. Вопрос №19Цифры, указанные рядом с символом это…
- 116. Молодец!
- 117. Вопрос №20 Порядковый номер элемента указывает
- 118. Молодец!
- 119. Вопрос №21 В каком ряду формулы
- 120. Молодец!
- 121. Молодец!Ты ответил на все вопросы данного раздела правильно!
- 122. Вернись обратно
- 123. Список источников основного содержанияhttp://ru.wikipedia.org/wiki/%CF%E5%F0%E8%EE%E4%E8%F7%E5%F1%EA%E0%FF_%F1%E8%F1%F2%E5%EC%E0_%F5%E8%EC%E8%F7%E5%F1%EA%E8%F5_%FD%EB%E5%EC%E5%ED%F2http://festival.1september.ru/articles/550165/http://festival.1september.ru/articles/518766/http://festival.1september.ru/articles/518545http://festival.1september.ru/articles/subjects/4?page=59.
- 124. Список источников иллюстрацийhttp://school1174.ru/about/news/Konkurs_Uchenik_goda/ мальчик в очкахhttp:///kartinki/russkij-jazyk/Slovarnye-slova-trenazhjor/014-E.html мальчик
- 125. Список источников иллюстрацийhttp://alexlat.ucoz.ru/_pu/12/49704461.jpg Д.И.Менделеев (цветное фото)http://rudocs.exdat.com/docs/index-226819.html?page=3 картинка
- 126. Список источников иллюстрацийhttp://www.liveinternet.ru/users/4491121/post180303977/ человек с пробиркой (слайд
- 127. Список источников иллюстрацийhttp://www.omgtu.ru/general_information/institutes/petrochemical_institute/department_of_quot_physical_chemistry_quot/the_teaching_process_1.php колбаhttp://forum.homka-spb.com/lite/referati/magazin-uchebnikov-angliyskogo-yazika.html три книгиhttp://zhigyly.org/page-shkola-molodie-g-moskvi колба
- 128. Скачать презентацию
- 129. Похожие презентации

























































































































Слайд 2 Обучающая программа для 8 класса «Периодический закон и
Периодическая система химических элементов Д. И. Менделеева»
Слайд 3
Биография
Д. И. Менделеева
Классификация химических элементов до
Д.
И. Менделеева
Периодический закон и Периодическая система химических элементов
Выход
Слайд 4 Д. И. Менделеев родился 27
января 1834 года в г. Тобольске в семье директора
Тобольской гимназии Ивана Павловича Менделеева и его жены Марии Дмитриевны. В 1849 г. Митя окончил Тобольскую гимназию. В 1850 г. Менделеевы переехали в Петербург. В конце лета 1850 г., после вступительных экзаменов, Дмитрий Менделеев был зачислен на физико-математический факультет Главного педагогического института. Он увлекался математикой, химией и физикой, интересовался предметами историко-философского факультета, а на старших курсах уделял большое внимание химии и минералогии. Его первой значительной исследовательской работой, выполненной под руководством профессора А. А. Воскресенского при выпуске из института, стала диссертация «Изоморфизм в связи с другими отношениями кристаллической формы при различии в составе».В 1855 г. Д. И. Менделеев окончил институт с золотой медалью, получил диплом старшего учителя. В 1855 - 1856 гг. работал учителем гимназии при Ришельевском лицее в Одессе.
С 1857 -1890 гг. преподавал в Петербургском университете, одновременно с 1864 по 1872 год работал профессором Технологического института в Петербурге. Кроме того, Д.И. Менделеев был преподавателем Владимировских и Бестужевских женских курсов.
В 1857 г. Д.И. Менделеев защитил диссертацию на тему «Удельные объемы».
В 1859 - 1861 г. Менделеев был в заграничной командировке где, работал в основном в организованной им лаборатории в Гейдельберге.
Биография Д. И. Менделеева
Слайд 5
Биография Д. И. Менделеева
Вернувшись в Петербург, Менделеев погрузился
в активную педагогическую, исследовательскую и литературную работу.
В
1860 г. открыл «температуру абсолютного кипения жидкостей». В 1861 г. написал первый в России учебник по органической химии, удостоенный престижной Демидовской премии. Тесно связаны с вопросами технологии перегонки первые работы Менделеева по переработке нефти.
В 1863 году он посетил нефтеперегонные предприятия в Сураханах вблизи Баку, где в те годы применялась технология, сходная с перегонкой древесины, дал ряд важных рекомендаций, касающихся условий транспортировки нефти.
В 1865 г. он защищает докторскую диссертацию на тему «О соединении спирта с водой».
В 1867 г. Д.И. Менделеев впервые стал читать курс неорганической химии в Петербургском университете. Тогда и родился замысел написать учебник «Основы химии» - фундаментальный труд Д. И. Менделеева. Учебник выдержавший только при жизни автора восемь изданий.
В ходе работы над 1-м изданием Д.И. Менделеев пришел к идее о периодической зависимости свойств химических элементов от их атомных весов. В 1869-1871 гг. изложил основы учения о периодичности свойств химических элементов, открыл периодический закон – фундаментальный закон природы и разработал периодическую систему химических элементов. На основе открытого им закона Д.И. Менделеев впервые предсказал (1870) существование и свойства 11 не открытых еще
Слайд 6
Биография Д. И. Менделеева
элементов, в том числе «экаалюминия»
— галлия (открыт в 1875 г.), «экабора» — скандия
(1879 г), «экасилиция» — германия (1886 г.), свойства которых прогнозировал с исключительной точностью и очень подробно. Последним из одиннадцати (1940) был открыт элемент № 85, предсказанный ученым экаиод, известный сегодня под названием астат. Выход «Основ химии» был значительным событием научной жизни России того времени. Появились восторженные отзывы в официальных журналах, коллеги выражали свою оценку в письмах к Д. И. Менделееву. Кроме того, «Основы химии» были переведены на английский, французский и немецкий языки. Учебником пользовались студенты и ученые многих стран Европы, а также Соединенных Штатов Америки.
Число читателей было исключительно велико — от гимназистов до академиков. Молодые ученые брали в «Основах химии» идеи, которые затем нередко развивали в своих трудах в течение многих лет. В качестве примера можно указать на известного металлурга академика А. А. Байкова и крупного радиохимика В. А. Бородовского, которые приобщились к химии благодаря учебнику Д.И.Менделеева, или на академика А. Е. Арбузова, которого заинтересовали сведения о производных фосфористой кислоты, что послужило толчком для исследований в этой области и возникновению новой области химии — химии фосфорорганических соединений .
Изучая газы, вывел в 1874 г. общее уравнение состояния идеального газа
(уравнение Клапейрона - Менделеева).
Слайд 7
Биография Д. И. Менделеева
Высказал в 1877 г. гипотезу
о неорганическом происхождении нефти из карбидов тяжелых металлов; предложил
принцип дробной перегонки при переработке нефти. Д. И. Менделеев принимал участие в разработке технологий запущенного в 1879 г. первого в России завода по производству машинных масел в посёлке Константиновский в Ярославской губернии, который ныне носит его имя.Работы Менделеева по изучению свойств газов инициировали его интерес к проблемам в области геофизики и метеорологии. Разрабатывая эти вопросы, Менделеев заинтересовался исследованиями атмосферы (особенно ее верхних слоев) с помощью летательных аппаратов. 7-го августа 1887 г. Менделеев совершил полет на воздушном шаре. За совершение этого полёта Д.И. Менделеев был удостоен медали Французского общества воздухоплавания.
В 1888 г. выдвинул идею о подземной газификации углей. Разработал в 1891-1892 г. технологию изготовления нового типа бездымного пороха. В 1892 г. — Дмитрий Иванович Менделеев — учёный-хранитель Депо образцовых гирь и весов, которое в 1893 г. по его инициативе было преобразовано в Главную палату мер и весов.
Разнообразие интересов Менделеева поражают: он собирал и систематизировал фотографии, любил фотографировать сам. Коллекционировал репродукции произведений искусства, виды мест, в которых бывал. Еще одним увлечением Д.И. Менделеева было изготовление чемоданов и рамок для портретов. До последних дней великий ученый трудился на благо своей Родины.
Слайд 8
Биография Д. И. Менделеева
20 января 1907 г. Дмитрий
Иванович Менделеев скончался. Похоронили его на Волковом кладбище в
Петербурге. На траурной процессии люди несли огромный транспарант с изображением Периодической системой.Его заслуги высоко оценены во всем мире. Д.И. Менделеев был избран членом и почетным членом более 90 академий наук, научных обществ, университетов и институтов разных стран мира. Имя Д.И. Менделеева носят химический элемент № 101, город Менделеевск в Татарстане, минерал, кратер на обратной стороне Луны, подводный горный хребет, Научно-исследовательский институт метрологии, Российский химико-технологический университет, вулкан и др.
Вопросы
1
2
5
4
3
12
11
10
9
8
7
6
Слайд 9
Вопрос №1
Б) 27 января 1834 года
в Тобольске
А) 27 февраля 1834 года в Петербурге
В) 8 февраля 1838 года в Тобольске
Когда и где родился Д.И. Менделеев?
Слайд 11
Вопрос №2
В) Изготовление чемоданов и рамок для портретов
А)
Чтение книг
Б) Работы по исследованию газов
У каждого человека
есть свое хобби. Чем любил заниматься Д. И. Менделеев в свободное время?
Слайд 13
Вопрос №3
А) Петербургский Главный педагогический институт
В) Московский Технологический
институт
Б) Казанский университет
Какое высшее учебное заведение окончил Д.И.Менделеев?
Слайд 16
Вопрос №4
А) «Органическая химия»
Б) «
Неорганическая химия»
В) «Основы химии»
Над каким учебником
работал Д. И Менделеев в период своего великого открытия?
Слайд 18
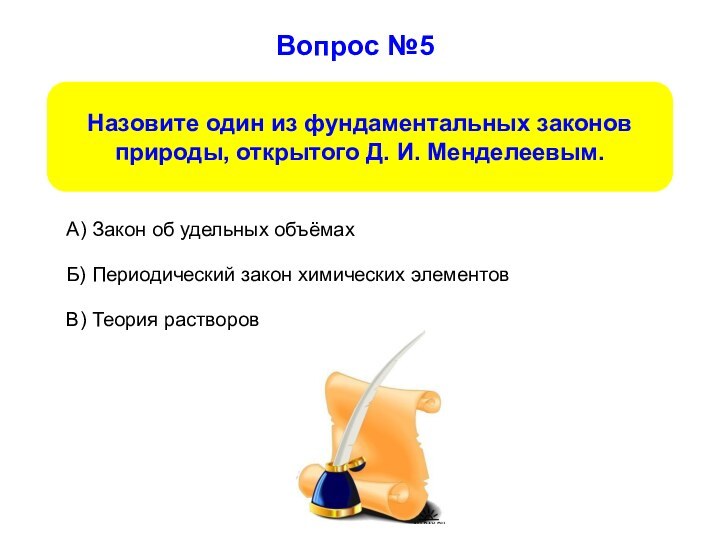
Вопрос №5
Б) Периодический закон химических элементов
А) Закон об
удельных объёмах
В) Теория растворов
Назовите один из фундаментальных законов природы,
открытого Д. И. Менделеевым.
Слайд 20
Вопрос №6
А) «экаалюминия», «экабора», «экасилиция»
Б) «экаалюминия», «экасилиция», «экайода»
В)
«экаалюминия», «экабора», «экасеры»
Существование и свойства каких химических элементов было
предсказано Д . И. Менделеевым?
Слайд 22
Вопрос №7
А) «О соединении спирта с водой»
Б) «Удельные
объёмы»
В) «Периодический закон»
На какую тему была защищена докторская диссертация
Д. И. Менделеевым в 1865 г.?
Слайд 24
Вопрос №8
В) А. А. Байков, А. Е. Арбузов
Б) В.В. Марковников, Г. А. Шмидт
А) С. И. Ковалевский,
П.П. Алексеев Какие учёные приобщились к химии благодаря учебнику Д. И. Менделеева «Основы химии»?
Слайд 26
Вопрос №9
В) Город Менделеевск в Ростовской области,
минерал , вулкан
Б) Река, остров в Тихом
океане, химический элемент МенделевийА) Город в Татарстане, минерал, кратер на обратной стороне Луны, подводный горный хребет, Научно -исследовательский институт метрологии, Российский химико-технологический университет, вулкан
Какие географические объекты названы именем Д.И.Менделеева?
Слайд 28
Вопрос №10
Б)
А)
В)
Укажите формулу состояния идеального
газа, которое вывел Д. И. Менделеев?
Слайд 30
Вопрос №11
Б) За изготовление бездымного пороха
А) За
идею о подземной газификации углей
В) За полёт на воздушном
шареЗа что Д.И. Менделеев был удостоен медали Французского общества?
Слайд 32
Вопрос №12
В) В Одессе
А) На Урале
Б) В Гейдельберге
Где находился Д. И. Менделеев во время
научной командировки с 1859 по 1861 года? Слайд 36 Многие учёные до Д. И. Менделеева предприняли попытки
классификации химических элементов. Ко времени открытия Периодического закона были
известны 63 химических элемента, описаны не только состав и свойства их многочисленных соединений, но и подмечены некоторые закономерности в их изменении. Было до 50 попыток классификации химических элементов.Одна из первых классификаций элементов основывалась на их распределении на металлы и неметаллы по общими физическим свойствам. Выдающийся шведский химик Йенс Якоб Берцелиус разделил все элементы на металлы и неметаллы на основе различий в свойствах, образованных ими простых веществ и соединений. Он определил, что металлам соответствуют основные оксиды и основания:Na→Na2O→NaOH, а неметаллам - кислотные оксиды и кислоты: S →SO2→H2SO3.
Но групп было всего две, они были велики, включали значительно отличающиеся друг от друга элементы. Наличие амфотерных оксидов и гидроксидов у некоторых металлов вносило путаницу. Классификация была несовершенной.
Каждый химический элемент весьма индивидуален по своей природе, но, в то же время, между отдельными элементами имеются сходные признаки. Основываясь на них немецкий учёный Иоганн Вольф Дёберейнер в 1829 г. предпринял значимую попытку классификации элементов. Он заметил, что некоторые сходные по свойствам элементы можно объединить по 3 в группы, которые он назвал триадами, триады Дёберейнера. Разделил элементы по три на основе сходства в свойствах
Классификация химических элементов до Д. И. Менделеева
Слайд 37 образуемых им веществ так, чтобы величина, которую мы
сейчас понимаем как относительную атомную массу элемента, была равна
среднему арифметическому масс двух крайних элементов в триаде: М (Na) = ( 7 + 39 ) / 2 = 23 г/моль.Несмотря на то, что триады Дёберейнера в какой-то мере являются прообразами менделеевских групп, эти представления в целом ещё слишком несовершенны. Отсутствие магния в едином семействе кальция, стронция и бария или кислорода в семействе серы, селена и теллура является результатом ограничения совокупностей сходных элементов лишь тройственными союзами. Очень показательна в этом смысле неудача Дёберейнера выделить триаду из четырех близких по своим свойствам элементов: P, As, Sb, Bi. Дёберейнер отчётливо видел глубокие аналогии в химических свойствах фосфора и мышьяка, сурьмы и висмута, но, заранее ограничив себя поисками триад, он не смог найти верного решения. Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в соответствии с их атомными массами.
А. Бегье де Шанкуртуа профессор Парижской высшей школы. В 1862 г. Александр Бегье де Шанкуртуа предложил расположить все известные в то время химические элементы в единой последовательности возрастания их атомных масс и полученный ряд наносил на поверхность
Классификация химических элементов до Д. И. Менделеева
Слайд 38 цилиндра по линии, исходящей из его основания под
углом 45° к плоскости основания (т. н. земная спираль).
При развертывании поверхности цилиндра оказывалось, что на вертикальных линиях, параллельных оси цилиндра, находились химические элементы со сходными свойствами. Недостатком спирали А. Бегье де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем с другими химическими свойствами.Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т. д. В группу щелочных металлов попадал марганец, в группу кислорода и серы — ничего общего с ними не имеющий титан.
Английский учёный Джон Ньюлендс в 1865 г. сделал попытку сопоставить химические свойства элементов с их атомными массам. Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом. Найденную закономерность Ньюлендс назвал законом октав по аналогии с семью интервалами музыкальной гаммы. В своей таблице он располагал химические элементы в вертикальные группы по семь элементов в каждой и при этом обнаружил, что (при небольшом изменении порядка некоторых элементов) сходные по химическим свойствам элементы оказываются на одной горизонтальной линии. Джон Ньюлендс, безусловно, первым дал ряд элементов, расположенных в порядке
Классификация химических элементов до Д. И. Менделеева
Слайд 39 возрастания атомных масс, присвоил химическим элементам соответствующий порядковый
номер и заметил систематическое соотношение между этим порядком и
физико-химическими свойствами элементов. Он писал, что в такой последовательности повторяются свойства элементов, эквивалентные веса (массы) которых отличаются на 7 единиц, или на значение, кратное 7, т. е. как будто бы восьмой по порядку элемент повторяет свойства первого, как в музыке восьмая нота повторяет первую. Ньюлендс пытался придать этой зависимости, действительно имеющей место для лёгких элементов, всеобщий характер.В его таблице в горизонтальных рядах располагались сходные элементы, однако в том же ряду часто оказывались и элементы совершенно отличные по свойствам. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица не содержала свободных мест.
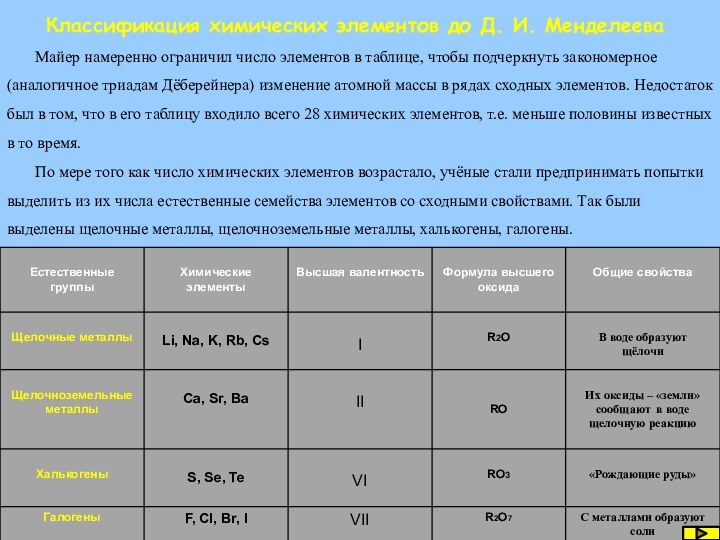
Лотар Майер немецкий химик в 1864 г. расположил химические элементы в порядке увеличения их атомных масс и по валентности, появилась первая таблица химических элементов. В неё были включены 28 элементов, размещённые в шесть столбцов.
Классификация химических элементов до Д. И. Менделеева
Слайд 40
Классификация химических элементов до Д. И. Менделеева
Майер намеренно
ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное
триадам Дёберейнера) изменение атомной массы в рядах сходных элементов. Недостаток был в том, что в его таблицу входило всего 28 химических элементов, т.е. меньше половины известных в то время.По мере того как число химических элементов возрастало, учёные стали предпринимать попытки выделить из их числа естественные семейства элементов со сходными свойствами. Так были выделены щелочные металлы, щелочноземельные металлы, халькогены, галогены.
Слайд 41
Классификация химических элементов до Д. И. Менделеева
Классификация на
естественные группы не объединяла химические элементы в единое целое,
т. е. классификация оставалась несовершенной.
Ни одна из попыток классификации химических элементов до Д. И. Менделеева не привела к созданию системы, отражающей взаимосвязь элементов и выявляющей природу их сходства и различия. Классификация химических элементов до Д. И. Менделеева была неточной, ненаучной, несовершенной, т. к. за основу классификации бралось не главное свойство («коренной признак») химического элемента.
Вопросы
1
2
3
4
5
6
7
8
9
10
11
12
Слайд 42
Вопрос №1
Кто установил закон триад?
А) Иоганн Вольф
Дёберейнер
Б) Джон Ньюлендс
В) Бегье де Шанкуртуа
Слайд 44
Вопрос №2
Английский химик Д. Ньюлендс (1863 г.), располагая
элементы последовательно в порядке возрастания их атомных масс, заметил,
что восьмой по счету элемент повторяет свойство первого, подобно повторению звуков в музыкальной октаве и назвал свою таблицу «законом октав»:
Какие недостатки были присущи данной классификации?
А) Ньюлендсу не удалось объяснить найденную закономерность, и в его таблице не было места для ещё неоткрытых химических элементов
Б) Ньюлендс располагал химические элементы в вертикальные группы
В) В некоторых ячейках находилось по два химических элемента
Слайд 46
Вопрос №3
Почему попытки классификации химических элементов до Д.
И. Менделеева были неудачными?
А) За основу классификации предшественники Менделеева
брали не совокупность основных свойств элементов Б) Классификация химических элементов содержала не все известные в то время элементы
В) Учёным не хватало информации о химических элементах
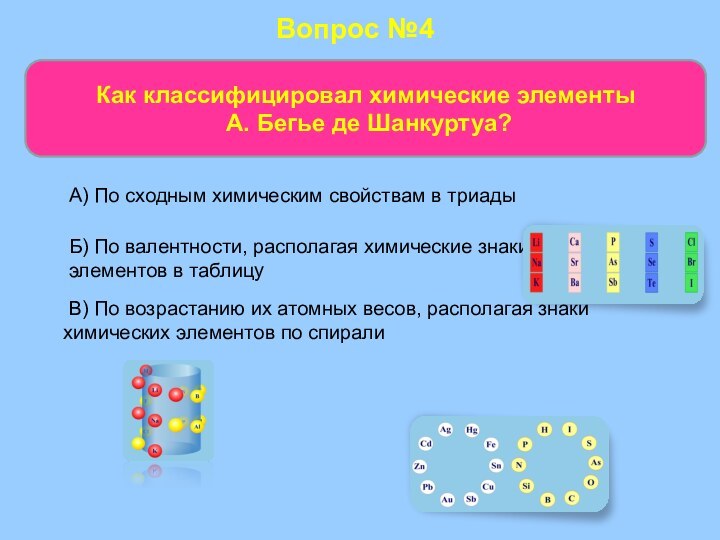
Слайд 48
Вопрос №4
Как классифицировал химические элементы
А. Бегье де
Шанкуртуа?
В) По возрастанию их атомных весов, располагая
знаки химических элементов по спиралиБ) По валентности, располагая химические знаки элементов в таблицу
А) По сходным химическим свойствам в триады
Слайд 50
Вопрос №5
Кто из учёных определил: металлам соответствуют -
основные оксиды, а
неметаллам – кислотные оксиды?
А) Дмитрий Иванович
Менделеев Б) Лотар Майер
В) Йенс Якоб Берцелиус
Слайд 52
Вопрос №6
Чему равна относительная атомная масса Sr –
стронция, рассчитанная по триаде Дёберейнера
Ca
Sr
Ba ?
А) 177
Б) 59
В) 88
Слайд 54
Вопрос №7
Какой немецкий химик расположил химические элементы в
порядке увеличения их атомных масс и по валентности?
А) Д.
Ньюлендс В) А. Бегье де Шанкуртуа
Б) Л. Майер
Слайд 56
Вопрос №8
Сколько было известно химических элементов ко времени
открытия Периодического закона
Д. И. Менделеева?
А) 65
В) 50
Б) 63
Слайд 58
Вопрос №9
Какие химические элементы относятся к халькогенам?
А) Na,
K, Li
В) Cl, F, Br
Б) Te, S,
Se
Слайд 64
Вопрос №12
Общее свойство галогенов
Б) с металлами образуют соли
В) «рождающие руды»
А) не образуют химических соединений
Слайд 68
В отличие от учёных - предшественников, Д.
И. Менделеев обнаружил закономерности в изменении свойств, сравнивая между
собой все известные ему 63 элемента. Целью поисков Д. И. Менделеева при создании Периодической системы химических элементов было нахождение закономерностей, которые объединяли бы все элементы в единую систему. И это ему удалось. В основу своей работы по классификации химических элементов, Д.И.Менделеевым было положено два признака: величины атомных весов и химические свойства. Он выписал на карточки все известные в то время сведения об открытых и изученных химических элементах и их соединениях.После этого Д. И. Менделеев разложил карточки с химическими элементами в ряд по увеличению относительных атомных масс и заметил, что через определённые интервалы в нём встречаются элементы, которые образуют сходные простые вещества и соединения. Сопоставляя эти сведения, учёный составил естественные группы сходных по свойствам элементов, сравнение которых между собой показало, что даже элементы несходных групп имеют объединяющие их признаки.
Периодический закон и Периодическая система химических элементов
Слайд 69
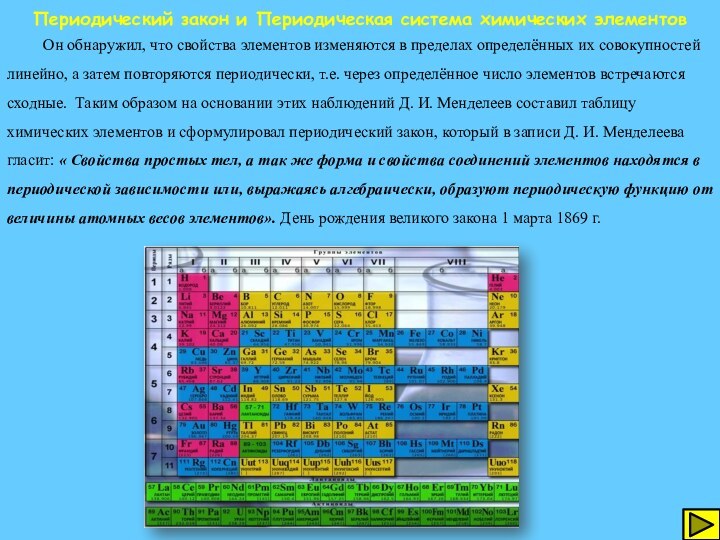
Периодический закон и Периодическая система химических элементов
Он
обнаружил, что свойства элементов изменяются в пределах определённых их
совокупностей линейно, а затем повторяются периодически, т.е. через определённое число элементов встречаются сходные. Таким образом на основании этих наблюдений Д. И. Менделеев составил таблицу химических элементов и сформулировал периодический закон, который в записи Д. И. Менделеева гласит: « Свойства простых тел, а так же форма и свойства соединений элементов находятся в периодической зависимости или, выражаясь алгебраически, образуют периодическую функцию от величины атомных весов элементов». День рождения великого закона 1 марта 1869 г.
Слайд 70
Периодический закон и Периодическая система химических элементов
Структура Периодической
системы химических элементов Д. И. Менделеева
Периодическая система состоит из
множества клеточек, в каждой из которых находятся символы химических элементов с такими важнейшими характеристиками, как: название химического элемента, порядковый номер, относительная атомная масса, конфигурация валентных электронов.Символ элемента
Название элемента
Порядковый (атомный)
номер
Относительная
атомная масса
Конфигурация валентных электронов
Слайд 71
Периодический закон и Периодическая система химических элементов
Важнейшей характеристикой
химического элемента является его порядковый номер. Порядковый номер химического
элемента равен числу протонов в ядре ( т.е. заряду ядра) и числу электронов в атоме:Порядковый (атомный) номер = Число электронов = Число протонов в ядре = Заряд ядра
В химии используют специальные обозначения атомов: заряд ядра, т.е. порядковый номер пишут слева внизу от символа химического элемента, а массовое число – слева вверху.
Например: массовое число А
порядковый номер Z
Разновидности атомов одного и того же химического элемента, которые имеют одинаковый заряд ядра, но разную массу ( массовое число), называют изотопами.
Например изотопы:
Это различие обусловлено неодинаковым числом нейтронов в ядре атомов этих изотопов. Общее число протонов и нейтронов в ядре называют массовым числом атома.
Al
27
13
Слайд 72
Периодический закон и Периодическая система химических элементов
Число нейтронов
(N) = Массовое число (A) - Число протонов
(Z)Для того чтобы рассчитать число нейтронов в атоме, необходимо взять округлённое значение массового числа в ПСХЭ или в таблице изотопов и вычесть заряд ядра, который равен порядковому номеру.
Например Al: массовое число (А) = 27, заряд ядра (Z) = 13, тогда число нейтронов равно
N = 27 – 13 = 14
Периодическая система химических элементов представляет собой таблицу, в которой выделяют периоды и группы.
Период – это горизонтальный ряд химических элементов , расположенных в порядке возрастания их атомных масс, начинающийся с щелочного металла (или с водорода для 1-го периода) и заканчивающийся благородным газом.
Различают:
1) малые периоды (1, 2, 3) – состоят из 1-ого ряда. В первом периоде 2 химических элемента , во втором и третьем по восемь.
2) большие периоды (4-7) – состоят из 2-х рядов. Содержат по 18 и более химических элементов. Седьмой период не завершён, в настоящее время не все предсказанные для этого периода химические элементы (№№ 113-118) открыты учеными.
Слайд 73
Периодический закон и Периодическая система химических элементов
Изменение химических
свойств в периода
Свойства элементов, а так же образованных ими
простых веществ и соединений в пределах периода закономерно изменяются.В каждом периоде с увеличением порядкового номера химического элемента заряд ядра и число валентных электронов в атомах последовательно возрастают. Валентные электроны – это электроны, которые обладают наибольшей энергией. Число валентных электронов равно номеру группы, в которой находиться химический элемент.
I. Радиус атомов в периоде слева на право уменьшается, а притяжение электронов к ядру увеличивается:
Радиусы атомов
химических элементов
(выражены в пикометрах 1пм = )
Слайд 74
Периодический закон и Периодическая система химических элементов
II. Металлические
свойства простых веществ, наиболее ярко выраженные у щелочных металлов,
слева направо ослабевают и сменяются неметаллическими, которые наиболее ярко выражены у галогенов: 1) Основные оксиды элементов начала периода сменяет амфотерный оксид и далее кислотные оксиды, кислотность которых усиливается слева направо:Na2O → MgO →Al2O3 →SiO2 →SO3 →Cl2O7
2) Гидроксиды - основания через амфотерный гидроксид сменяются все более сильными кислотами :
NaOH→ Mg(OH)2 →Al(OH)3 →H2SiO3 →H3PO4→ H2SO4 →HClO4 II. Значение валентности атомов в высших оксидах, как правило, возрастает от I до VIII.
Период
Группа
Слайд 75 Способность атомов притягивать валентные электроны других атомов называют
электроотрицательностью ( ЭО).
Сильнее всего притягивают электроны атомы наиболее
активных металлов : F, O, Cl, так как им до завершения внешнего уровня не достаёт одного или двух электронов. Поэтому их ЭО наибольшая.Легче всего отдают электроны атомы активных металлов, в первую очередь щелочных: Li, Na, K. Они обладают наименьшей ЭО. По электроотрицательности атомов химические элементы можно расположить следующим образом:
Периодический закон и Периодическая система химических элементов
Электроотрицательность возрастает
Электроотрицательность
уменьшается
Слайд 76 Кроме горизонтальной, по периодам, периодичности в системе химических
элементов наблюдается периодичность вертикальная, по группам.
Группа – вертикальный столбец
химических элементов. Номер группы, как правило, совпадает с высшей валентностью химического элемента, которую он проявляет в соединении с кислородом.Помимо кислородных соединений большое значение имеют соединения с водородом, которые наиболее типичны для неметаллов. Для определения валентности элемента в этих соединениях надо из 8 вычесть номер группы., в которой находиться неметаллический элемент.
Группа делится на подгруппы:
главная (А) – входят элементы как малых, так и больших периодов;
2) побочная (В) – входят только элементы больших периодов. Побочные подгруппы составлены только из элементов металлов, которые называют переходными металлами.
Изменение химических свойств в группах
I. Радиус атомов увеличивается и притяжение валентных электронов к ядру ослабевает,
поэтому:
II. Металлические свойства возрастают при увеличении атомной массы,
а неметаллические ослабевают: LiOH → NaOH → KOH → RbOH
II. Значение валентности элементов в высших оксидах, как правило, не изменяется.
Периодический закон и Периодическая система химических элементов
Группа
Период
Слайд 77
Значение Периодического закона
- Его открытие дало
мощнейший толчок в развитии физических и химических знаний;
- Были
разработаны теории строения атома и химической связи. Благодаря Периодической системе химических элементов Д. И. Менделеева
- Сложилось современное понятие о химическом элементе;
- Были уточнены представления о простых веществах и соединениях;
- Появление периодической системы открыло новую, научную эру в истории химии и ряде смежных наук, появилась естественная система химических элементов, на основе которой стало возможным обобщать, делать выводы, предвидеть свойства химических элементов, способов их получения и строения их атомов.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева являются основой современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения свойств.
«Периодическому закону будущее не грозит разрушением,
а только надстройка и развитие обещаются»
Д. И. Менделеев
Периодический закон и Периодическая система химических элементов
Слайд 78
Периодический закон и Периодическая система химических элементов
Вопросы
3
4
5
6
7
1
2
11
13
15
17
9
10
12
14
16
8
18
19
20
21
Слайд 79
Вопрос №1
Что положил в основу классификации химических элементов
Д. И. Менделеев?
Б) Атомный вес и химические свойства
А) Химические
свойства В) Атомный вес
Слайд 81
Вопрос №2
Элементы, которые размещены в четвёртой группе побочной
подгруппы…
А) K, Ca, Sc
Б) C, Si, Ge
В) Ti,
Zr, Hf
Слайд 83
Вопрос №3
Кислотный характер соединений в ряду
BeO -
B2O3 - CO2 - N2O5
А) Возрастает
Б) Ослабевает
В) Не изменяется
Слайд 85
Вопрос №4
Какое свойство характерно для всех химических элементов?
А)
Металлические свойства
В) Валентность
Б) Кислотные свойства
Слайд 87
Вопрос №5
Какова авторская формулировка
Периодического закона
Д. И.
Менделеева?
А) Свойства химических элементов и образуемых ими веществ находятся
в периодической зависимости от зарядов их атомных ядерБ) Свойства элементов, а потому и свойства образуемых ими простых и сложных тел находятся в периодической зависимости от их химических свойств
В) Свойства простых тел, а так же форма и свойства соединений элементов находятся в периодической зависимости или, выражаясь алгебраически, образуют периодическую функцию от величины атомных весов элементов
Слайд 89
Вопрос №6
Группа – это…
А) горизонтальный ряд химических элементов
, расположенных в порядке возрастания их атомных масс, начинающийся
с водорода или щелочного металла и заканчивающийся благородным газомВ) горизонтальный столбец химических элементов,
расположенных в порядке возрастания атомного
радиуса атомов
Б) вертикальный столбец химических элементов, в котором номер группы, как правило, совпадает с высшей валентностью химических элементов
Слайд 91
Вопрос №7
Период – это…
А) горизонтальный ряд химических элементов
, расположенных в порядке возрастания их атомных масс, начинающийся
с щелочного металла и заканчивающийся галогеномБ) вертикальный столбец химических элементов, в котором номер группы, как правило, совпадает с высшей валентностью
В) горизонтальный ряд химических элементов , расположенных в порядке возрастания их атомных масс, начинающийся с водорода или щелочного металла и заканчивающийся благородным газом
Слайд 93
Вопрос №8
Химические элементы B, C, N, O, F
расположены в порядке …
А) усиления металлических свойств
Б) ослабевания
неметаллических свойствВ) усиления неметаллических свойств
Слайд 95
Вопрос №9
В какой паре элементов наиболее выражены металлические
свойства?
А) кальция и бериллия
Б) калия и бериллия
В) калия и
лития
Слайд 99
Вопрос №11
В побочные группы Периодической системы входят элементы
…
А) больших и малых периодов
Б) только малых периодов
В) только
больших периодов
Слайд 101
Вопрос №12
Укажите формулу элемента, атом которого имеет наибольшее
число электронов
А) B
Б) N
В) Cl
Слайд 103
Вопрос №13
Разновидности атомов одного и того же химического
элемента, которые имеют одинаковый заряд ядра, но разную массу
( массовое число)…А) Изотоны
В) Изобары
Б) Изотопы
Слайд 105
Вопрос №14
Сколько электронов, протонов и нейтронов содержится в
атоме иода
А) 53,53, 106
Б) 53, 74, 53
В) 53, 53,
74
Слайд 107
Вопрос №15
От кислотных к основным меняются свойства оксидов
в ряду
А) K2O →Na2O →MgO
Б) Li2O →BeO →N2O5
В)
SO3 → Al2O3 →Na2O
Слайд 109
Вопрос №16
В ряду химических элементов P – As
- Sb
А) увеличивается значение электроотрицательности
Б) уменьшается число протонов
в ядреВ) усиливается основный характер высших оксидов
Слайд 111
Вопрос №17
В ряду химических элементов K – Ca
- Ga
В) уменьшается число протонов в ядре
Б) уменьшается
валентность атомовА) уменьшаются радиусы атомов
Слайд 113
Вопрос №18
Благодаря открытию Периодического закона и Периодической системе
химических элементов
Д. И. Менделеева…
А) понятие вещество приобрело
новый смысл Б) сложилось представлении об атоме как о сложной структуре
В) сложилось современное представление о химическом элементе
Слайд 115
Вопрос №19
Цифры, указанные рядом с символом это…
А) массовое число и число нейтронов
Б) заряд ядра
и валентностьВ) порядковый номер и массовое число
Слайд 117
Вопрос №20
Порядковый номер элемента указывает на…
А)
число валентных электронов
В) число энергетических уровней
Б) число протонов
и электронов
Слайд 119
Вопрос №21
В каком ряду формулы химических
элементов расположены в порядке увеличения радиуса атома?
А) Sb, As,
P, N В) C, N, O, F
Б) N, P, As, Sb
Слайд 123
Список источников основного содержания
http://ru.wikipedia.org/wiki/%CF%E5%F0%E8%EE%E4%E8%F7%E5%F1%EA%E0%FF_%F1%E8%F1%F2%E5%EC%E0_%F5%E8%EC%E8%F7%E5%F1%EA%E8%F5_%FD%EB%E5%EC%E5%ED%F2
http://festival.1september.ru/articles/550165/
http://festival.1september.ru/articles/518766/
http://festival.1september.ru/articles/518545
http://festival.1september.ru/articles/subjects/4?page=59.
Слайд 124
Список источников иллюстраций
http://school1174.ru/about/news/Konkurs_Uchenik_goda/ мальчик в очках
http:///kartinki/russkij-jazyk/Slovarnye-slova-trenazhjor/014-E.html мальчик с
карандашом и с книгой
http://www.liveinternet.ru/showjournal.php?journalid=3371375&keywordid=1220333 книга с очками, бумага с
чернильницей и пером, книга с бумагой и чернильницейhttp://www.liveinternet.ru/users/4652061/post259349852 химические элементы (фон 1 и 2-ого слайда)
http://piqoge.teleskoro.ru/63743.html мальчик за партой, мальчик сидит с книгами, мальчик идёт с книгами, мальчик и рядом вопросительный знак
http://gorinalw.3dn.ru/index/vitaminy/0-66 птица с книгами
http://www.freetorg.com.ua/lead/search/?q=%E6%E8%E4%EA%EE%F1%F2%E5%E9&p=7
http://prodlenka93.ru/ мальчик сидит за столом с тетрадями,учебниками о чёч-то думает
Слайд 125
Список источников иллюстраций
http://alexlat.ucoz.ru/_pu/12/49704461.jpg Д.И.Менделеев (цветное фото)
http://rudocs.exdat.com/docs/index-226819.html?page=3 картинка опыты
системы элементов
http://fcior.edu.ru/card/3875/otkrytie-periodicheskogo-zakona.html (информационный модуль) учёные:Берцелиус, Ньюлендс, Дёберейнер, Шанкуртуа,
таблички с химическими элементами http://aksakal.info/science-news/21389-v-tablice-mendeleeva-poyavitsya-element-nazvannyy-v-chest-moskvy.html жёлтая картинка с химическими элементами
http://h2o.u-sonic.ru/teor/teors/pic3_1.htm шкала электроотрицательности элементов по Полингу
http://turservice-ram.ru/i/bg/referati/tematicheskoe-planirovanie-po-himii-11-klass-1-chas-gabrielyan.html на картинке 2 колбы,учебник и доска
http:///kartinki/khimija/Viktorina/082-1911-g.-God-rozhdenija-atomnoj-fiziki-a-XX-vek-atomnyj-vek.html орбитали слайд 117
Слайд 126
Список источников иллюстраций
http://www.liveinternet.ru/users/4491121/post180303977/ человек с пробиркой (слайд 13)
http://45.ru/forum/theme.php?id=599508
человечек с указкой на книге
http://www.doodoo.ru/smiles/verybig/vb070.gif смайлик показывает класс анимация
http://www.doodoo.ru/smiles/verybig/vb061.gif
смайлик читает книгу анимацияhttp://www.sapo.biz.pl/ang/18/isotopes-in-nuclear-symbol-notation изотопы лития
http://physik.ucoz.ru/photo/atomnaja_i_jadernaja_fizika/26 изотопы водорода
http:///fotografii/khimija/Jod-v-organizme-cheloveka/004-Jod.html иод
http://www.topic.lt/miru_mir/173999-kniga-vseobshhix-zabluzhdenij.-chast-2.-30-foto.html атомы (слайд 119)
http://ru.wikipedia.org/wiki/%CC%E5%ED%E4%E5%EB%E5%E5%E2,_%C4%EC%E8%F2%F0%E8%E9_%C8%E2%E0%ED%EE%E2%E8%F7 родители Д.И. Менделеева (4 слайд)
Слайд 127
Список источников иллюстраций
http://www.omgtu.ru/general_information/institutes/petrochemical_institute/department_of_quot_physical_chemistry_quot/the_teaching_process_1.php колба
http://forum.homka-spb.com/lite/referati/magazin-uchebnikov-angliyskogo-yazika.html три книги
http://zhigyly.org/page-shkola-molodie-g-moskvi колба и
химические элементы
http://byfly.ws/lastnews/page/82/ Периодическая система химических элементов Д.И.Менделеева
http://www.km.ru/referats/73E0B0ECE2154735977663F7FE9DAECE табличка с
химическими элементами (в центре магний)http://school20.hostedu.ru/ незнайка
http://www.liveinternet.ru/showjournal.php?journalid=1547340&keywordid=426618&page=5 сова (анимация)
http://ostx.pp.ua/kak-sdelat-lazernuyu-ukazku.html сова с указкой
http://wap.mobilmusic.ru/fileanim.html?id=855462 книга (анимация)
http://koledj.ru/docs/index-6579.html уравнение состояния идеального газа