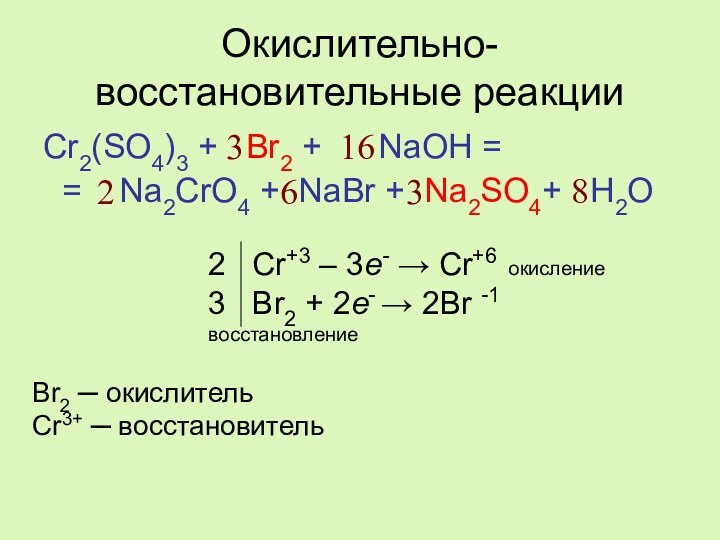
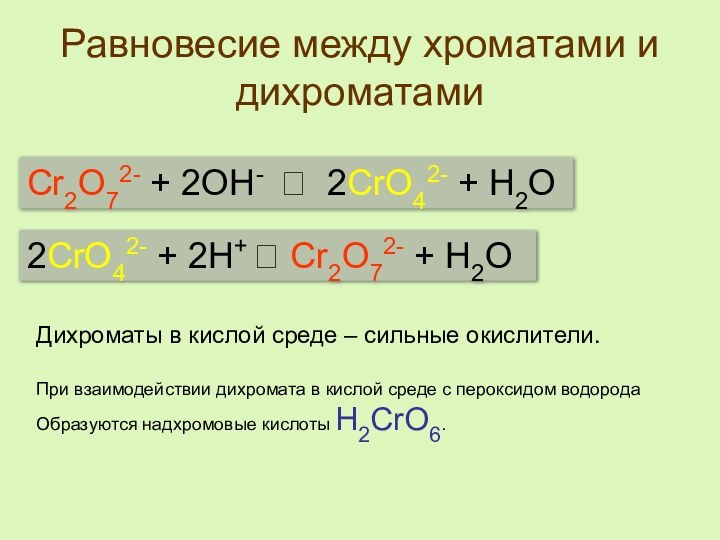
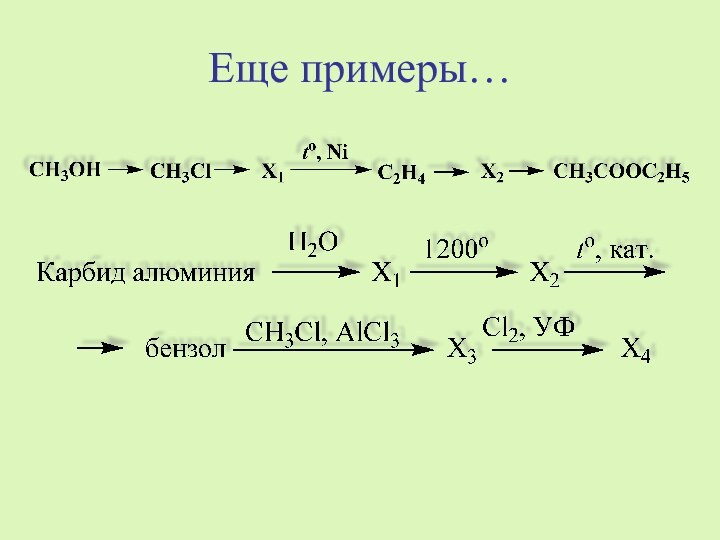
реакции:
Cr2(SO4)3 + … + NaOH =
= Na2CrO4
+ NaBr + … + H2OОпределите окислитель и восстановитель.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



![Обзор заданий блока С Окисление Cr(III) в Cr(VI)[Cr(OH)6]3- + 3 H2O2 = CrO42– + 2OH- +](/img/tmb/11/1085724/7307e9e774433a4f5e618eca25d4532a-720x.jpg)

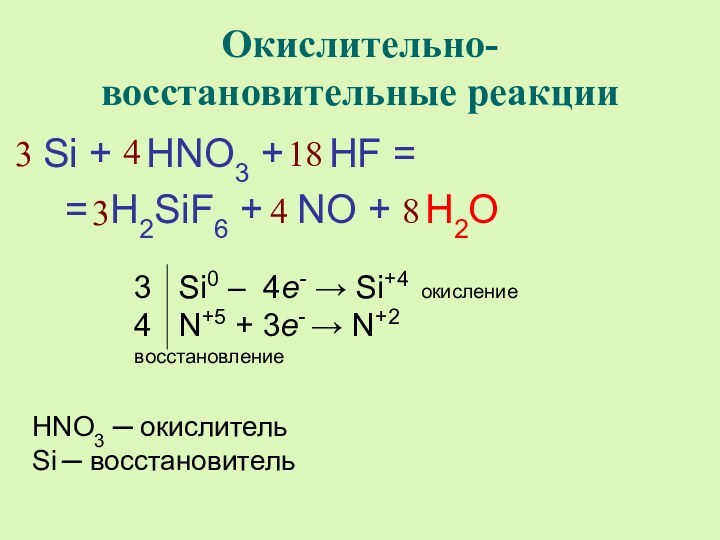
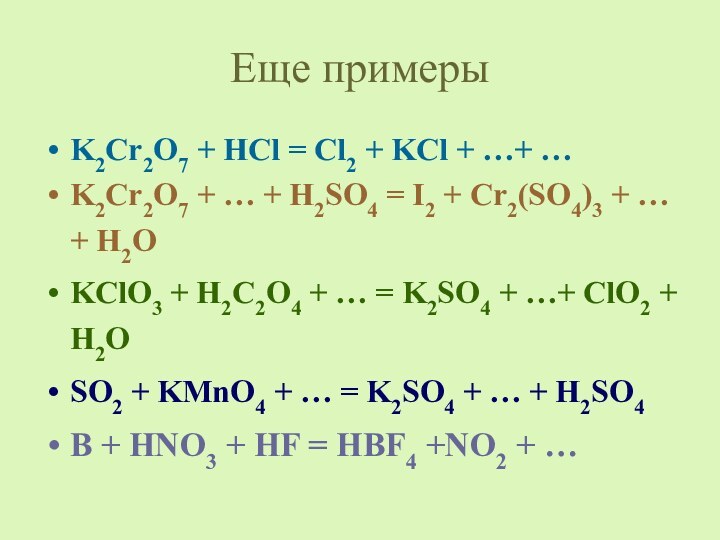












2 Cr+3 – 3e- → Cr+6 окисление
3 Br2 + 2e- → 2Br -1 восстановление
2
3
6
16
3
8
Br2 ─ окислитель
Cr3+ ─ восстановитель
Дихроматы в кислой среде – сильные окислители.
При взаимодействии дихромата в кислой среде с пероксидом водорода
Образуются надхромовые кислоты H2CrO6.
Желтый раствор, полученный в предыдущем опыте, нагрейте до кипения,
Охладите под струей холодной воды, прибавьте 5 капель раствора H2O2,
Примерно 0,5 мл амилового спирта, тщательно перемешайте и прибавляйте
По каплям раствор H2SO4 (1 моль/л).
Верхний органический слой окрашивается в интенсивно синий цвет.
4
3 Si0 – 4e- → Si+4 окисление
4 N+5 + 3e- → N+2 восстановление
18
4
8
HNO3 ─ окислитель
Si ─ восстановитель
3
3
Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
Медь массой 6,4 г обработали 100 мл 30%-ным раствором азотной кислоты (ρ=1,153 г/мл). Для полного связывания продуктов к полученному раствору добавили 200 г раствора гидроксида натрия. Определите массовую долю щелочи в использованном растворе.
Разобрать пример задачи?
По уравнению реакции x = 0,5y, то есть y = 2x
С учетом относительных атомных масс
азота и водорода
составим и решим уравнение:
14x + 2x = 32
x = 2; y = 4
Ответ: N2H4, гидразин