- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Электролитическая диссоциация
Содержание
- 2. Цель урокаПознакомиться с процессами, происходящими в растворах
- 3. Задачи урокаРассмотреть различия между веществами-электролитами и неэлектролитамиДать
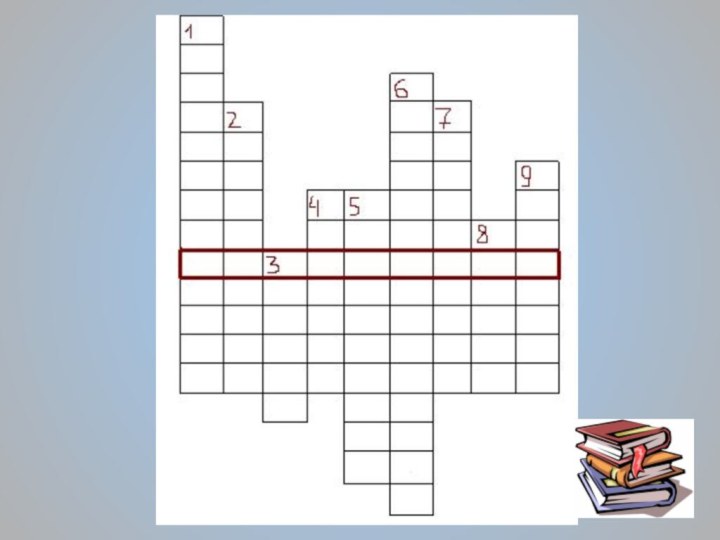
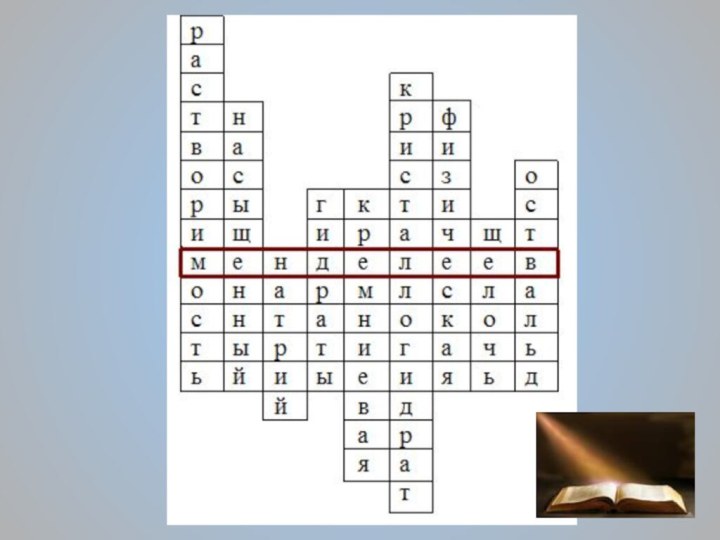
- 4. КРОССВОРД
- 6. Странные результаты исследованийВ разбавленных растворах поваренной соли
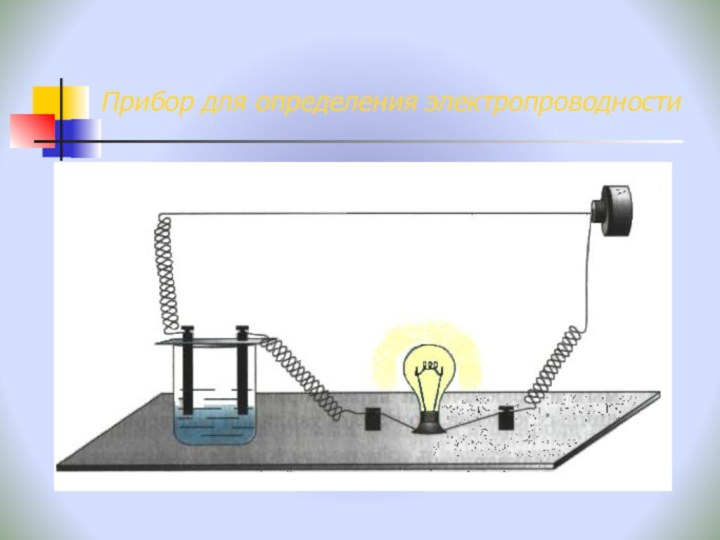
- 7. Прибор для определения электропроводности
- 8. Прибор для определения электропроводности
- 9. Запомните!Вещества, растворы которых проводят электрический ток, называются электролитами.Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
- 10. С. Аррениус, 1887г.:причина электропроводности ─
- 11. Процесс распада электролита на ионы в растворе называется электролитической диссоциацией (от лат. dissociatio – «разделение»
- 12. ЭЛЕКТРОЛИТЫНЕЭЛЕКТРОЛИТЫвещества с ковалентной сильнополярной связьювещества с ионной
- 13. Механизм диссоциацииС. Аррениус ─ не учитывал взаимодействия электролита с водой. В растворах находятся свободные ионы:
- 14. Ионыкатионы(+)анионы(─)При написании уравнений диссоциации сумма положительных и
- 15. Заметка о диссоциации растворенных веществ (1889 г.)
- 16. Менделеев против АррениусаРастворение – химический процессРаствор –
- 17. Механизм диссоциацииИ.А. Каблуков, В.А. Кистяковский ─ при
- 18. Молекулы воды представляют собой диполи
- 19. Механизм диссоциации ионного соединенияNaCl ⮀ Na+ + Cl-гидратированные ионыдиполи воды
- 20. Механизм диссоциации полярной молекулыH+ Cl-H+Cl-H+Cl-+HCl ⮀ H+ + Cl-
- 21. Запомните!Процесс, обратный диссоциации, когда движущиеся гидратированные ионы
- 22. Степень диссоциации (α)
- 23. Сильныеα ≥ 30%Слабыеα ≤ 3%Электролитырастворимые солисильные кислоты
- 24. Уравнения диссоциации электролитовДиссоциация кислотHCl = H+ +
- 25. Уравнения диссоциации электролитовДиссоциация основанийNaOH = Na+ +
- 26. Уравнения диссоциации электролитовДиссоциация солейКBr = K+ +
- 27. Упражнения
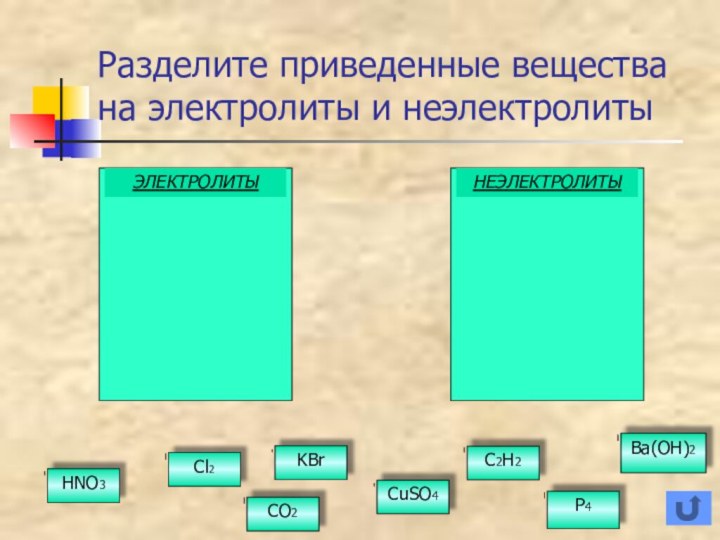
- 28. Разделите приведенные вещества на электролиты и неэлектролитыЭЛЕКТРОЛИТЫНЕЭЛЕКТРОЛИТЫCl2HNO3CO2KBrCuSO4C2H2Ba(OH)2P4
- 29. Запишите уравнения ЭД веществ в растворе:Карбонат натрияСульфат алюминияГидроксид меди (II)Хлорид железа (III)Фосфорная кислотаНитрат магния
- 30. Выпишите отдельно формулы кислот, солей и оснований.
- 31. Домашнее задание§35, 36.Упр. 4, 5 стр. 152.Подготовить сообщения о В.А. Кистяковском, И.А. Коблукове, С. Аррениусе
- 32. Скачать презентацию
- 33. Похожие презентации
Цель урокаПознакомиться с процессами, происходящими в растворах






















Слайд 3
Задачи урока
Рассмотреть различия между веществами-электролитами и неэлектролитами
Дать определение
понятию «электролитическая диссоциация»
солей, кислот и оснований
Слайд 6
Странные результаты исследований
В разбавленных растворах поваренной соли число
«молекул» вдвое больше, чем вычисленное по формуле NaCl, а
в растворах CaCl2 – втрое больше и т.д.
Слайд 9
Запомните!
Вещества, растворы которых проводят электрический ток, называются электролитами.
Вещества,
растворы которых не проводят электрический ток, называются неэлектролитами.
Слайд 10
С. Аррениус, 1887г.:
причина электропроводности ─ наличие
в растворе ионов, которые образуются при растворении электролита в
воде
Слайд 11 Процесс распада электролита на ионы в растворе называется
электролитической диссоциацией
(от лат. dissociatio – «разделение»
Слайд 12
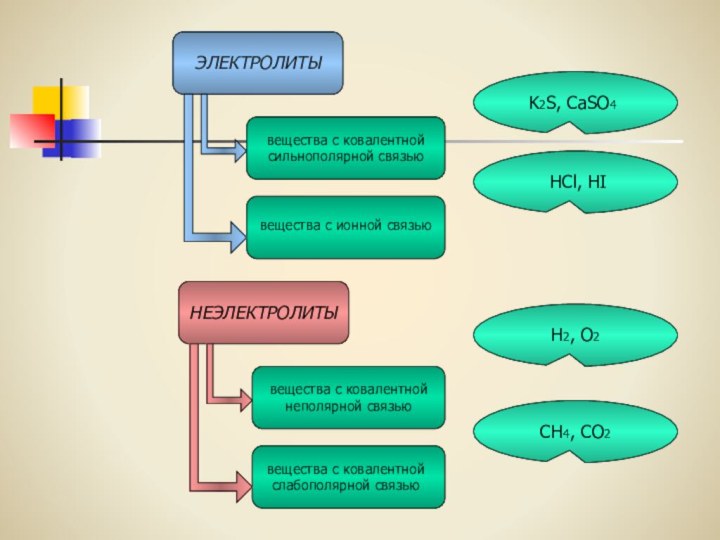
ЭЛЕКТРОЛИТЫ
НЕЭЛЕКТРОЛИТЫ
вещества с ковалентной сильнополярной связью
вещества с ионной связью
вещества
с ковалентной неполярной связью
вещества с ковалентной слабополярной связью
K2S, CaSO4
HCl,
HIH2, O2
CH4, CO2
Слайд 13
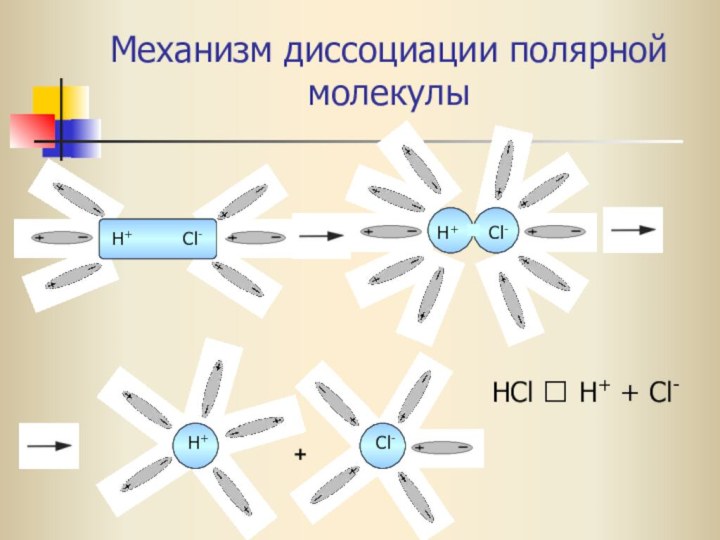
Механизм диссоциации
С. Аррениус ─ не учитывал взаимодействия электролита
с водой. В растворах находятся свободные ионы:
Слайд 14
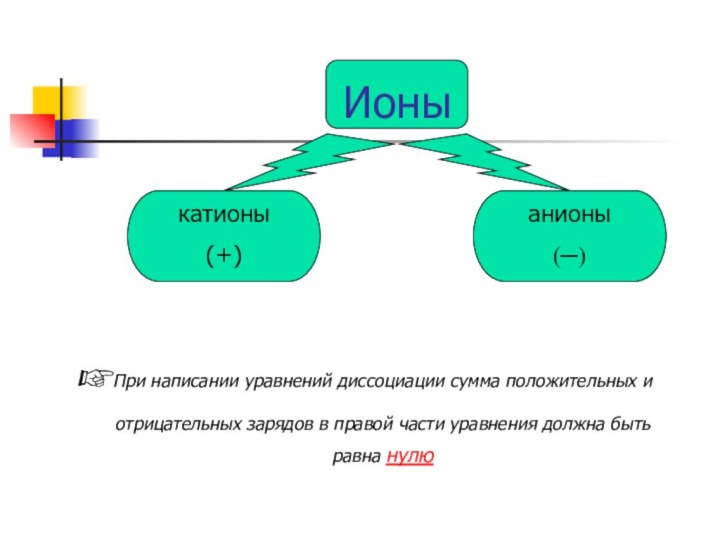
Ионы
катионы
(+)
анионы
(─)
При написании уравнений диссоциации сумма положительных и отрицательных
зарядов в правой части уравнения должна быть равна нулю
Слайд 15
Заметка о диссоциации растворенных веществ (1889 г.) Д.И.
Менделеева
«Сохраняя все то, что приобретено в отношении к пониманию
растворов, мне кажется, можно оставить в стороне гипотезу об особом виде диссоциации – на ионы, совершающейся с электролитами при образовании слабых растворов»
Слайд 16
Менделеев против Аррениуса
Растворение – химический процесс
Раствор – результат
химических взаимодействий между растворенным веществом и растворителем
Растворение – процесс
диффузииРаствор – результат смешивания молекул растворенного вещества и растворителя
Растворы электролитов состоят из ионов
Электролитическая диссоциация, как и растворение – физико-химический процесс
Слайд 17
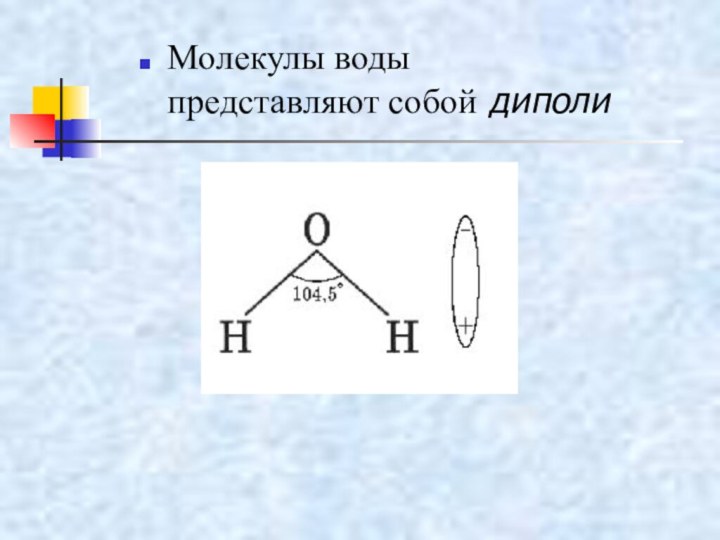
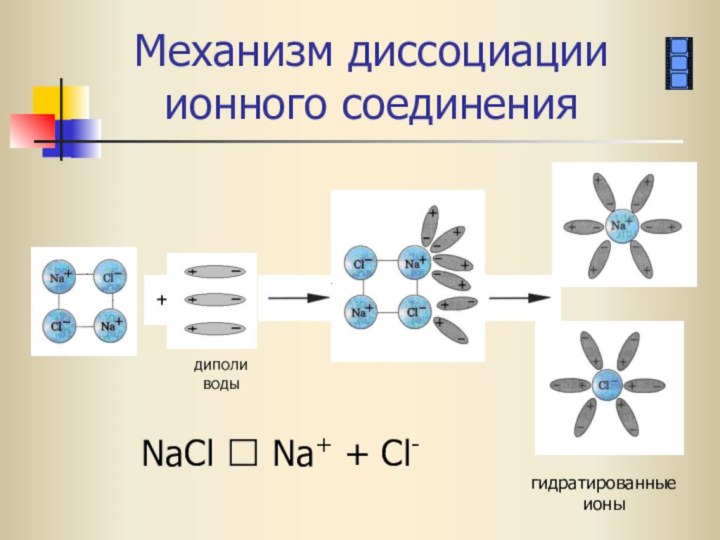
Механизм диссоциации
И.А. Каблуков, В.А. Кистяковский ─ при растворении
электролита происходит химическое взаимодействие растворенного вещества с водой, которое
приводит к образованию гидратов, а затем они диссоциируют на ионы. В растворах находятся не свободные, а гидратированные ионы
Слайд 21
Запомните!
Процесс, обратный диссоциации, когда движущиеся гидратированные ионы сталкиваются
и вновь объединяются между собой в молекулы, называется
ассоциацией
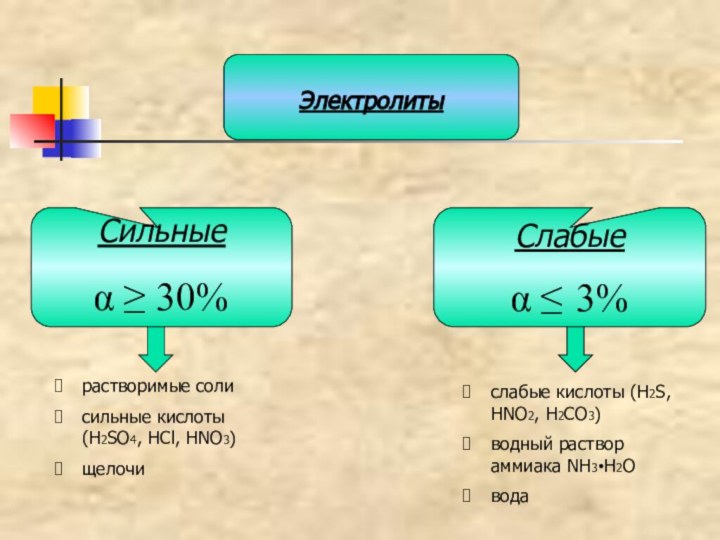
Слайд 23
Сильные
α ≥ 30%
Слабые
α ≤ 3%
Электролиты
растворимые соли
сильные кислоты (H2SO4,
HCl, HNO3)
щелочи
слабые кислоты (H2S, HNO2, H2CO3)
водный раствор аммиака NH3•H2O
вода
Слайд 24
Уравнения диссоциации электролитов
Диссоциация кислот
HCl = H+ + Cl-
H2SO4
= 2H+ + SO42-
Кислотами называют электролиты,
которые при диссоциации
образуют катионы водорода и анионы кислотного остатка
Слайд 25
Уравнения диссоциации электролитов
Диссоциация оснований
NaOH = Na+ + OH-
Ca(OH)2
= Ca2+ + 2OH-
Основаниями называют электролиты,
которые при диссоциации
образуют катионы металла и гидроксид-анионы
Слайд 26
Уравнения диссоциации электролитов
Диссоциация солей
КBr = K+ + Br-
Na2SO4
= 2Na+ + SO42-
Солями называют электролиты,
которые при диссоциации
образуют катионы металла и анионы кислотного остатка





























