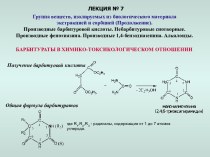
азотной кислоты ,особенностях ее взаимодействия с металлами.
История открытия
Получение
III. Физические
свойства азотной кислоты;IV. Химические свойства азотной кислоты;
V. Применение.
VI. Воздействие на человека
ПЛАН УРОКА