- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
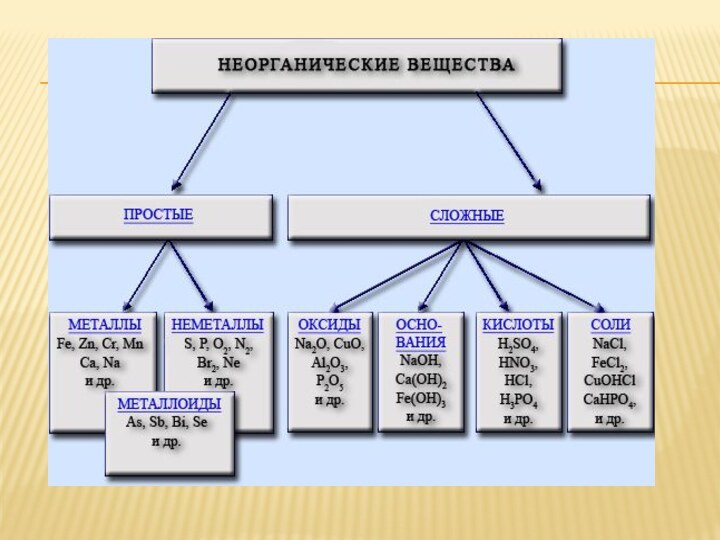
Презентация на тему Основные классы неорганических соединений
Содержание
- 3. ОКСИДЫОксидами называются бинарные соединения, содержащие кислород в
- 4. КЛАССИФИКАЦИЯ ОКСИДОВ-оксидыСолеобразующиеНесолеобразующиеСолеобразныеN2OPb3O4, Fe3O4 ОсновныеАмфотерныеКислотныеNa2O, CaOAl2O3, BeO, ZnOSO3, CO2, N2O3
- 5. * Несолеобразующими называются оксиды, которым не
- 6. Солеобразующими называются оксиды, которые образуют соли. Они
- 7. Амфотерными оксидами называются оксиды, которые в зависимости
- 8. СПОСОБЫ ПОЛУЧЕНИЯ ОКСИДОВ1. При взаимодействии простых веществ:S
- 9. 2. В результате горения бинарных соединений в
- 10. 3. При термическом разложении солей:CaCO3 = CaO
- 11. 4. Термическое разложение оснований и кислородсодержащих кислот:H2SO3
- 12. 5. Если химический элемент образует несколько оксидов:а)
- 13. 6. Некоторые металлы, стоящие в ряду напряжений
- 14. 8. При взаимодействии металлов с кислотами-окислителями происходит
- 15. 9. При действии водоотнимающих веществ на кислоты
- 16. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВОсновные оксиды взаимодействуют с кислотами
- 17. Кислотные оксиды (кроме SiO2) взаимодействуют с водой:SO3 + H2O
- 18. Несолеобразующие оксиды NO, N2O, SiO, CO могут реагировать с кислотами
- 19. КИСЛОТЫ И ОСНОВАНИЯСуществуют несколько теорий кислот и
- 20. Кислоты – электролиты, которые при диссоциации в
- 21. КИСЛОТЫ (по электролитической теории)Классификация неорганических кислот:1. По
- 22. 3. Сила кислот.- слабые - H2SO3, H2S;-
- 23. 6. По соотношению воды и кислотного оксида.-
- 24. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ1. Бескислородные:- взаимодействие простых веществ:H2
- 25. Общие способы:1. Взаимодействие между солью и кислотой.NaCN
- 26. 4. Окисление неметаллов азотной кислотой.3P + 5HNO3
- 27. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТКислоты реагируют с основаниями (а
- 28. Взаимодейcтвуют с металлами. Обычные кислоты (неокислители) взаимодействуют
- 29. Термически неустойчивые кислоты разлагаются при комнатной температуре
- 30. ОСНОВАНИЯКлассификация неорганических оснований:1. По кислотности.- однокислотные –
- 31. 2. Сила оснований.- слабые – NH4OH;- сильные
- 32. СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ1. Взаимодействие щелочных и щелочноземельных
- 33. 2. Растворением оксидов и пероксидов щелочных и
- 34. 4. Смешиванием водных растворов, взаимно усиливающих гидролиз:2AlCl3
- 35. 7. Осаждением из растворов солей щелочами или
- 36. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙОсновные гидроксиды реагируют с кислотами
- 37. Амфотерные гидроксиды реагируют и с кислотами (в
- 38. СОЛИ Соли - сложные вещества, которые состоят из
- 39. Средние. При диссоциации дают только катионы металла (или NH4+)Na2SO4 ↔ 2Na+ +SO42-CaCl2
- 40. Основные соли - продукты неполного замещения групп OH соответствующего
- 41. Комплексные. Содержат сложные катионы или анионы.[Ag(NH3)2]Br ↔ [Ag(NH3)2]+ + Br -Na[Ag(CN)2] ↔ Na+ + [Ag(CN)2]-
- 42. ПОЛУЧЕНИЕ СОЛЕЙ (СРЕДНИЕ)Большинство способов получения солей основано
- 43. 4) основного оксида с кислотным оксидом:MgO + CO2 ↔ MgCO3 5) основного
- 44. 8) соли с кислотой: MgCO3 + 2HCl ↔ MgCl2 + H2O
- 45. КИСЛЫЕ СОЛИ - ПОЛУЧЕНИЕ 1. Взаимодействие кислоты
- 46. ОСНОВНЫЕ СОЛИ - ПОЛУЧЕНИЕ 1. Гидролиз солей, образованных
- 47. КОМПЛЕКСНЫЕ СОЛИ - СТРОЕНИЕ K4[Fe(CN)6]K4[Fe(CN)6]– Внешняя сфераK4[Fe(CN)6]– Внутренняя сфераK4[Fe(CN)6]– Комплексообразователь (центральный атом)K4[Fe(CN)6]– Координационное числоK4[Fe(CN)6]– Лиганд
- 48. Центральными атомами обычно служат ионы металлов больших
- 49. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙСоли реагируют с металлами, эти
- 50. Скачать презентацию
- 51. Похожие презентации
ОКСИДЫОксидами называются бинарные соединения, содержащие кислород в степени окисления -2 . К оксидам относятся все соединения элементов с кислородом, например Fe2O3, P4O10, кроме содержащих атомы кислорода, связанные химической связью друг с другом (переоксиды, надпереоксиды, озониды).




































![Основные классы неорганических соединений Комплексные. Содержат сложные катионы или анионы.[Ag(NH3)2]Br ↔ [Ag(NH3)2]+ + Br -Na[Ag(CN)2] ↔ Na+ + [Ag(CN)2]-](/img/tmb/15/1468720/7daeeb72f81c8d0f1707561f06a7793b-720x.jpg)



![Основные классы неорганических соединений КОМПЛЕКСНЫЕ СОЛИ - СТРОЕНИЕ K4[Fe(CN)6]K4[Fe(CN)6]– Внешняя сфераK4[Fe(CN)6]– Внутренняя сфераK4[Fe(CN)6]– Комплексообразователь (центральный атом)K4[Fe(CN)6]– Координационное числоK4[Fe(CN)6]– Лиганд](/img/tmb/15/1468720/3c34b5aeaff1298ceaf3faee15eb9593-720x.jpg)


Слайд 3
ОКСИДЫ
Оксидами называются бинарные соединения, содержащие кислород в степени
окисления -2 .
кислородом, например Fe2O3, P4O10, кроме содержащих атомы кислорода, связанные химической связью друг с другом (переоксиды, надпереоксиды, озониды).
Слайд 4
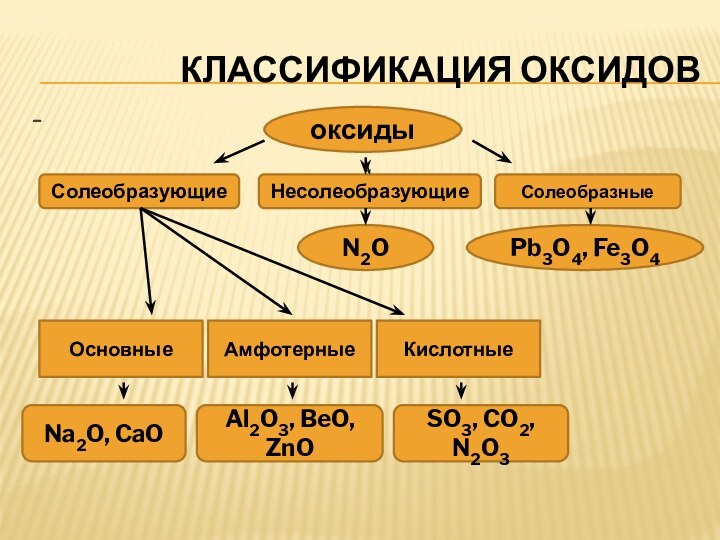
КЛАССИФИКАЦИЯ ОКСИДОВ
-
оксиды
Солеобразующие
Несолеобразующие
Солеобразные
N2O
Pb3O4, Fe3O4
Основные
Амфотерные
Кислотные
Na2O, CaO
Al2O3, BeO, ZnO
SO3, CO2,
N2O3
Слайд 5 * Несолеобразующими называются оксиды, которым не соответствуют
ни кислоты, ни основания.
* Солеобразными называются оксиды, в
состав которых входят атомы одного металла в разных степенях окисления.Например, Fe3O4 представляет из себя два оксида: основный оксид FeO,химически связанный с амфотерным оксидом Fe2O3, который в данном случае проявляет свойства кислотного оксида.
Слайд 6 Солеобразующими называются оксиды, которые образуют соли. Они подразделяются
на три класса: основные, амфотерные и кислотные.
Основными оксидами называются
оксиды, элемент которых при образовании соли или основания становятся катионом.Кислотными оксидами называются оксиды, элемент которых при образовании соли или кислоты входит в состав аниона.
Слайд 7 Амфотерными оксидами называются оксиды, которые в зависимости от
условий реакции могут проявлять как свойства кислотных, так и
свойства основных оксидов.При образовании солей степени окисления элементов, образующих оксиды, не изменяются:
CaO + CO2 = CaCO3
Слайд 8
СПОСОБЫ ПОЛУЧЕНИЯ ОКСИДОВ
1. При взаимодействии простых веществ:
S +
O2 = SO2
Ca + O2 = 2CaO
Оксиды
щелочных металлов (кроме лития) получают:Na2O2 + 2Na = 2Na2O
Слайд 9
2. В результате горения бинарных соединений в кислороде:
2CuSe
+ 3O2 = 2CuO + 2SeO2
4FeS2 + 11O2 =
2Fe2O3 + 8SO24PH3 + 8O2 = P4O10 + 6H2O = H3PO4
CS2 + 3O2 = CO2 + 2SO2
2Ca3P2 + 8O2 = 6CaO + P4O10
Слайд 10
3. При термическом разложении солей:
CaCO3 = CaO +
CO2
Карбонаты щелочных металлов плавятся без разложения (кроме Li2CO3)
2Cu(NO3)2 =
2CuO + 4NO2 + O24Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2
(NH4)2Cr2O7 = N2 + 4H2O + Cr2O3
Слайд 11
4. Термическое разложение оснований и кислородсодержащих кислот:
H2SO3 =
SO2 + H2O
H2SiO3 = SiO2 + H2O
Ca(OH)2 = CaO
+ H2OГидроксиды щелочных металлов плавятся без разложения.
Слайд 12
5. Если химический элемент образует несколько оксидов:
а) окислением
низших оксидов
4FeO + O2 = 2Fe2O3
2NO + O2 =
2NO2б) восстановлением высших оксидов
Fe2O3 + CO = 2FeO + CO2
Слайд 13 6. Некоторые металлы, стоящие в ряду напряжений до
водорода, могут при высокой температуре вытеснить водород из воды,
образуя оксид металла:Fe + H2O = FeO + H2 (t = 600oC)
7. При нагревании солей с кислотными оксидами:
Na2CO3 + SiO2 = Na2SiO3 + CO2
2Ca3(PO4)2 + 6SiO2 = 6CaSiO3 + P4O10
Слайд 14 8. При взаимодействии металлов с кислотами-окислителями происходит частичное
восстановление кислотообразующего элемента с образованием оксида:
Cu + 2H2SO4 (к)
= СuSO4 + SO2 + 2H2OZn + 4HNO3 (к) = Zn(NO3)2 + 2NO2 + 2H2O
Слайд 15 9. При действии водоотнимающих веществ на кислоты или
соли:
P4O10 + 4HNO3 (к) = 4HPO3 + 2N2O5
2KMnO4 +
H2SO4 (к) = K2SO4 + Mn2O7 + 2H2O10. При взаимодействии солей слабых неустойчивых кислот с растворами сильных кислот:
Na2CO3 + 2HCl (к) = 2NaCl + CO2 + H2O
Слайд 16
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Основные оксиды взаимодействуют с кислотами с
образованием соли и воды, например:
CuO + 2HCl = CuCl2 +
H2OMnO + H2SO4 = MnSO4 + H2O
Основные оксиды, образованные щелочными и щелочноземельными металлами взаимодействуют с водой с образованием щелочей:
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Слайд 17
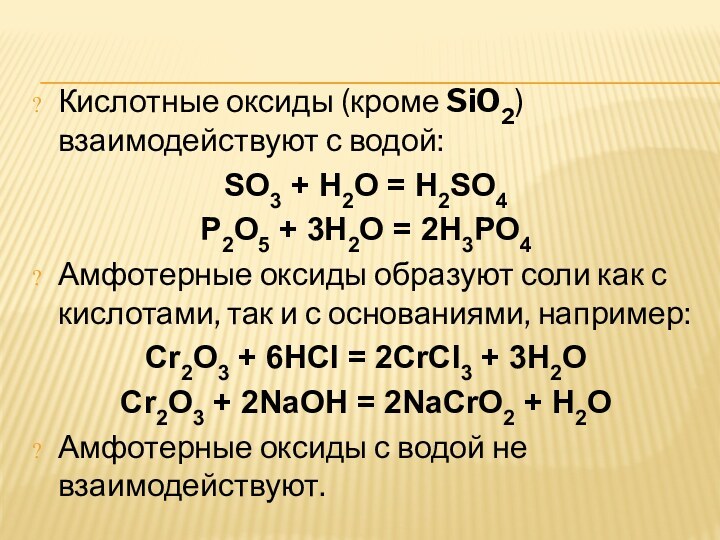
Кислотные оксиды (кроме SiO2) взаимодействуют с водой:
SO3 + H2O =
H2SO4
P2O5 + 3H2O = 2H3PO4
Амфотерные оксиды образуют соли как с
кислотами, так и с основаниями, например:Cr2O3 + 6HCl = 2CrCl3 + 3H2O
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
Амфотерные оксиды с водой не взаимодействуют.
Слайд 18 Несолеобразующие оксиды NO, N2O, SiO, CO могут реагировать с кислотами или
щелочами, но при этом не образуются продукты, характерные для
солеобразующих оксидов, например при 150oС и 1,5 МПа СО реагирует с гидроксидом натрия с образованием соли – формиата натрия:СО + NaOH = HCOONa
Слайд 19
КИСЛОТЫ И ОСНОВАНИЯ
Существуют несколько теорий кислот и оснований.
Рассмотрим основную.
1.Электролитическая теория.
На основании теории электролитической диссоциации,
предложенной шведским химиком С.Аррениусом можно дать определения кислотам и основаниям:Слайд 20 Кислоты – электролиты, которые при диссоциации в водных
растворах в качестве катионов дают только катионы водорода (гидроксония
Н30+) и анионы кислотного остатка:HNO3 = H+ + NO3-
Основания – электролиты, которые при диссоциации в водных растворах, в качестве катионов дают только анионы гидроксила (OН-) и катионы:
KOH = K+ + OH-
Слайд 21
КИСЛОТЫ (по электролитической теории)
Классификация неорганических кислот:
1. По содержанию
кислорода в кислотном остатке.
- бескислородные – HCl;
- Кислородсодержащие –
H2SO4.2. По основности.
- одноосновные – HCl, HNO3;
- многоосновные - H2SO4, H3PO4.
Основность кислоты – число ионов водорода, которые обмениваются на катионы металла.
Слайд 22
3. Сила кислот.
- слабые - H2SO3, H2S;
- сильные
- H2SO4, HCl.
4. Устойчивость кислот.
- неустойчивые - H2CO3;
- устойчивые
– HCl.5. По растворимости.
- нерастворимые в воде - H2SiO3;
- растворимые в воде - H2SO4.
Слайд 23
6. По соотношению воды и кислотного оксида.
- орто
(H3PO4); 1 : 3
- мета (HPO3); 1 :
1- пиро (получаются из орто-кислот при высокой t в результате отщепления воды);
2H3PO4 = H4P2O7 + H2O
- переменного состава (xSiO2 x yH2O).
Слайд 24
СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ
1. Бескислородные:
- взаимодействие простых веществ:
H2 +
Cl2 = 2HCl
- при горении органических
галогенсодержащих соединений
2CH3Cl + O2
= 2CO2 + 2H2O + 2HCl2. Кислородсодержащие:
- растворение оксида в воде:
SO3 + H2O= H2SO4
Слайд 25
Общие способы:
1. Взаимодействие между солью и кислотой.
NaCN +
HCl = NaCl + HCN
2. Взаимодействие солей, гидролизующихся полностью,
c водой.Al2S3 + 6H2O = Al(OH)3 + H2S
3. Гидролиз галогенгидридов кислот.
PBr5 + 4H2O = H3PO4 + 5HBr
Слайд 26
4. Окисление неметаллов азотной кислотой.
3P + 5HNO3 +
2H2O = 3H3PO4 + 5NO
S + 2HNO3 = H2SO4
+ 2NO5. Окисление кислотообразующего элемента до более высокой степени окисления.
H3PO3 + 2H2O2 = H3PO4 + H2O
H2SO3 + 2H2O2 = H2SO4 + H2O
HNO2 + H2O2 = HNO3 + H2O
Слайд 27
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Кислоты реагируют с основаниями (а также
с основными и амфотерными оксидами и гидроксидами) с образованием
солей. Например:HCl + NaOH = NaCl + H2O
H2SO4 + Fe(OH)2 = FeSO4 + 2H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
Слайд 28 Взаимодейcтвуют с металлами. Обычные кислоты (неокислители) взаимодействуют с
металлами, стоящими в ряду напряжений левее водорода:
Fe + 2HCl
= FeCl2 + H2 Zn + H2SO4(р) = ZnSO4 + H2
Кислоты окислители могут реагировать как с металлами, расположенными в ряду напряжений левее водорода, например:
5Zn + 12HNO3(р) = 5Zn(NO3)2 + 6H2O + N2
так и правее его:
Ag + 2HNO3(к) = AgNO3 + H2O + NO2
Слайд 29 Термически неустойчивые кислоты разлагаются при комнатной температуре или
при легком нагревании:
H2СO3 = СO2 + H2O
H2SO3 = SO2 +
H2O (t)H2SiO3 = SiO2 + H2O (t)
Слайд 30
ОСНОВАНИЯ
Классификация неорганических оснований:
1. По кислотности.
- однокислотные – NaOH,
KOH;
- многокислотные – Ca(OH)2, Al(OH)3.
Кислотность основания –
число ОН-групп, способных обмениваться на кислотный остаток.
Слайд 31
2. Сила оснований.
- слабые – NH4OH;
- сильные -
NaOH.
3. Термическая устойчивость.
- разлагающиеся на оксиды и воду -
Cu(OH)2;- плавящиеся без разложения - NaOH.
4. По растворимости.
- нерастворимые в воде - Fe(OH)3;
- растворимые в воде - KOH.
5. По соотношению к кислотам и щелочам.
- oсновные – KOH, NaOH;
- aмфотерные - Be(OH)2, Al(OH)3.
Слайд 32
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Взаимодействие щелочных и щелочноземельных металлов
с водой.
2Na + 2H2O = 2NaOH + H2
Sr
+ 2H2O = Sr(OH) 2 + H2 Также получают гидроксид аммония
NH3 + H2O = NH4OH
Слайд 33 2. Растворением оксидов и пероксидов щелочных и щелочноземельных
металлов в воде:
CaO + H2O = Ca(OH)2
Na2O2 +
2H2O = 2NaOH + H2O2 3. Взаимодействие солей, гидролизующихся полностью, c водой.
Al2S3 + 6H2O = 2Al(OH)3 + H2S
Слайд 34
4. Смешиванием водных растворов, взаимно усиливающих гидролиз:
2AlCl3 +
3Na2CO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3CO2
5.
Разложением некоторых бинарных соединений металл-неметалл водой:Li3N + 3H2O = 3LiOH + NH3
Ca3P2 + 6H2O = 3Ca(OH) 2 + 2PH3
Mg2Si + 4H2O = 2Mg(OH) 2 + SiH4
6. Электролизом водных растворов хлоридов щелочных и щелочноземельных металлов:
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Слайд 35 7. Осаждением из растворов солей щелочами или раствором
аммиака.
MgSO4 + 2KOH = Mg(OH)2 + K2SO4
AlCl3 + 3NH4OH
= Al(OH)3 + 3NH4Cl8. Окислением катиона, находящегося в низшей степени окисления, до высшей.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Слайд 36
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Основные гидроксиды реагируют с кислотами с
образованием соли и воды, например:
Сu(OH)2 + H2SO4 = CuSO4 + 2H2O
Щелочи реагируют
с кислотными и амфотерными оксидами:Ca(OH)2 + CO2 = CaCO3 + H2O
2NaOH + Fe2O3 = 2NaFeO2 + H2O
Слайд 37 Амфотерные гидроксиды реагируют и с кислотами (в этом
случае они ведут себя как основания), и со щелочами
(как кислоты), например:Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Cлабые основания и амфотерные гидроксиды при нагревании разлагаются:
Cu(OH)2 = CuO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Слайд 38
СОЛИ
Соли - сложные вещества, которые состоят из атомов
металла и кислотных остатков. Это наиболее многочисленный класс неорганических
соединений.Соли классифицируют:
Средние
Кислые
Основные
Двойные
Смешанные
Комплексные
Слайд 39
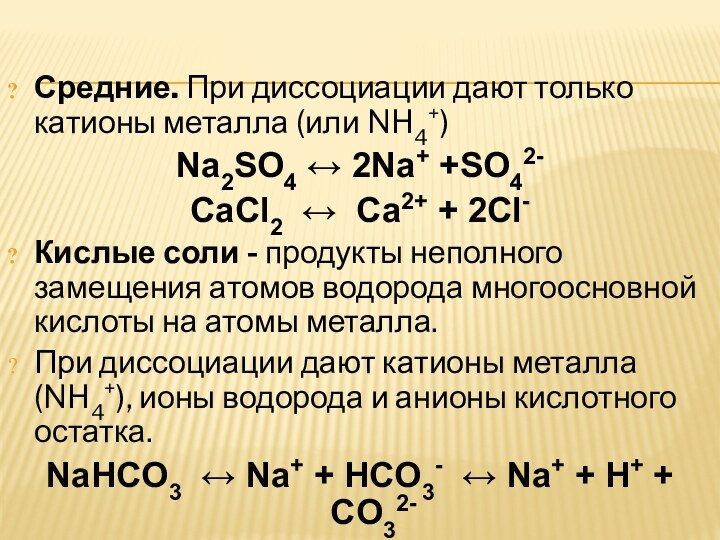
Средние. При диссоциации дают только катионы металла (или NH4+)
Na2SO4 ↔ 2Na+ +SO42-
CaCl2 ↔
Ca2+ + 2Cl-
Кислые соли - продукты неполного замещения атомов водорода
многоосновной кислоты на атомы металла.При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 ↔ Na+ + HCO3- ↔ Na+ + H+ + CO32-
Слайд 40 Основные соли - продукты неполного замещения групп OH соответствующего основания
на кислотные остатки.
При диссоциации дают катионы металла,
анионы гидроксила и кислотного остатка.Zn(OH)Cl ↔ [Zn(OH)]+ + Cl- ↔ Zn2+ + OH- + Cl-
Двойные. При диссоциации дают два катиона и один анион.
KAl(SO4)2 ↔ K+ + Al3+ + 2SO42-
Смешанные. Образованы одним катионом и двумя анионами:
CaOCl2 ↔ Ca2+ + Cl- + OCl-
Слайд 41
Комплексные. Содержат сложные катионы или анионы.
[Ag(NH3)2]Br ↔ [Ag(NH3)2]+ + Br -
Na[Ag(CN)2] ↔ Na+ +
[Ag(CN)2]-
Слайд 42
ПОЛУЧЕНИЕ СОЛЕЙ (СРЕДНИЕ)
Большинство способов получения солей основано на
взаимодействии веществ с противоположными свойствами:
1) металла с неметаллом:
2Na + Cl2 ↔ 2NaCl
2) металла
с кислотой:Zn + 2HCl ↔ ZnCl2 + H2
3) металла с раствором соли менее активного металла
Fe + CuSO4 ↔ FeSO4 + Cu
Слайд 43
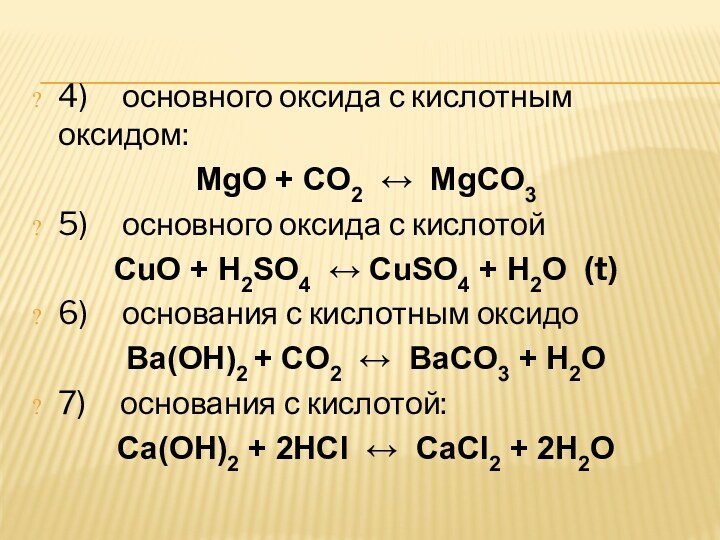
4) основного оксида с кислотным оксидом:
MgO + CO2 ↔ MgCO3
5) основного оксида
с кислотой
CuO + H2SO4 ↔ CuSO4 + H2O (t)
6) основания с кислотным
оксидо Ba(OH)2 + CO2 ↔ BaCO3 + H2O
7) основания с кислотой:
Ca(OH)2 + 2HCl ↔ CaCl2 + 2H2O
Слайд 44
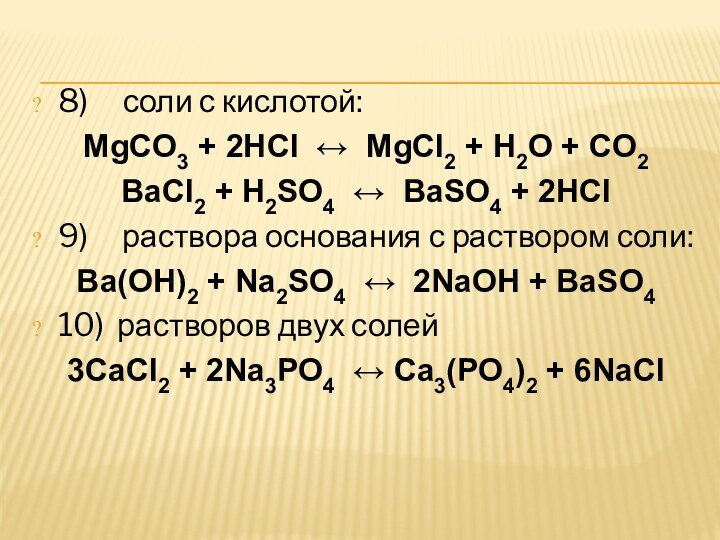
8) соли с кислотой:
MgCO3 + 2HCl ↔ MgCl2 + H2O +
CO2
BaCl2 + H2SO4 ↔ BaSO4 + 2HCl
9) раствора основания с раствором
соли:Ba(OH)2 + Na2SO4 ↔ 2NaOH + BaSO4
10) растворов двух солей
3CaCl2 + 2Na3PO4 ↔ Ca3(PO4)2 + 6NaCl
Слайд 45
КИСЛЫЕ СОЛИ - ПОЛУЧЕНИЕ
1. Взаимодействие кислоты с недостатком
основания.
KOH + H2SO4 ↔ KHSO4 + H2O
2. Взаимодействие основания с избытком
кислотного оксидаCa(OH)2 + 2CO2 ↔ Ca(HCO3)2
3. Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 ↔ 3Ca(H2PO4)2
Слайд 46
ОСНОВНЫЕ СОЛИ - ПОЛУЧЕНИЕ
1. Гидролиз солей, образованных слабым основанием
и сильной кислотой
ZnCl2 + H2O ↔ [Zn(OH)]Cl + HCl
2. Добавление (по
каплям) небольших количеств щелочей к растворам средних солей металловAlCl3 + 2NaOH ↔ [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O ↔
↔ [Mg(OH)]2CO3 + CO2 + 4NaCl
Слайд 47
КОМПЛЕКСНЫЕ СОЛИ - СТРОЕНИЕ
K4[Fe(CN)6]
K4[Fe(CN)6]
– Внешняя сфера
K4[Fe(CN)6]
– Внутренняя
сфера
K4[Fe(CN)6]
– Комплексообразователь (центральный атом)
K4[Fe(CN)6]
– Координационное число
K4[Fe(CN)6]
– Лиганд
Слайд 48 Центральными атомами обычно служат ионы металлов больших периодов
(Co, Ni, Pt, Hg, Ag, Cu); типичными лигандами являются OH-, CN-NH3, CO, H2O; они связаны с центральным атомом донорно-акцепторной
связью.Получение:
1. Реакции солей с лигандами:
AgCl + 2NH3 ↔ [Ag(NH3)2]Cl
FeCl3 + 6KCN ↔ K3[Fe(CN)6] + 3KCl
Слайд 49
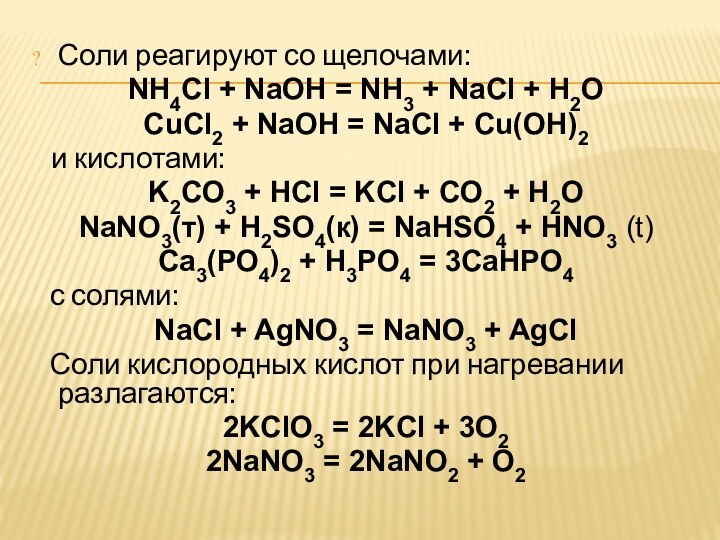
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Соли реагируют с металлами, эти реакции
всегда окислительно-восстановительные:
Fe + CuSO4 = Cu + FeSO4
Cu + FeCl3 =
CuCl + FeCl2C неметаллами, это также окислительно-восстановительные реакции:
S + Na2SO3 = Na2S2O3
При кипячении с водой, образуют кристаллогидраты:
CuSO4 + 5Н2О = CuSO4 •5H2O
Na2SO4 + 10Н2О = Na2SO4 •10H2O
или необратимо гидролизуются:
Al2S3 + 6Н2O = 2Al(OH)3 + 3H2S





























