- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Тепловой эффект химических реакций
Содержание
- 2. Химические явления – химические реакцииХимическая реакция
- 3. Признаки химических реакций Изменение цветаВыделение газаОбразование или растворение осадкаПоявление или исчезновение запахаВыделение или поглощение тепла
- 4. Классификация химических реакций по тепловому эффектуидут
- 5. Термохимия - раздел химии, в задачу которого
- 6. По термохимическим уравнениям реакций можно проводить различные
- 12. Скачать презентацию
- 13. Похожие презентации
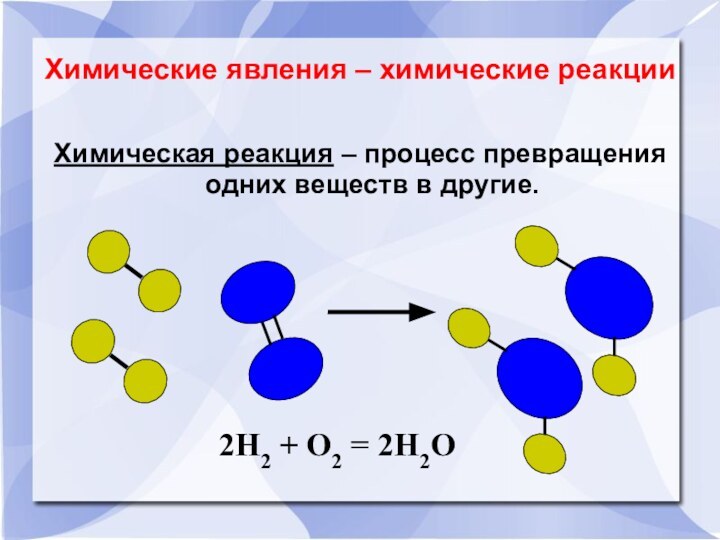
Химические явления – химические реакцииХимическая реакция – процесс превращения одних веществ в другие.2Н2 + О2 = 2Н2О










Слайд 2
Химические явления – химические реакции
Химическая реакция –
процесс превращения одних веществ в другие.
2Н2О
Слайд 3
Признаки химических реакций
Изменение цвета
Выделение газа
Образование или растворение осадка
Появление
или исчезновение запаха
Выделение или поглощение тепла
Слайд 4
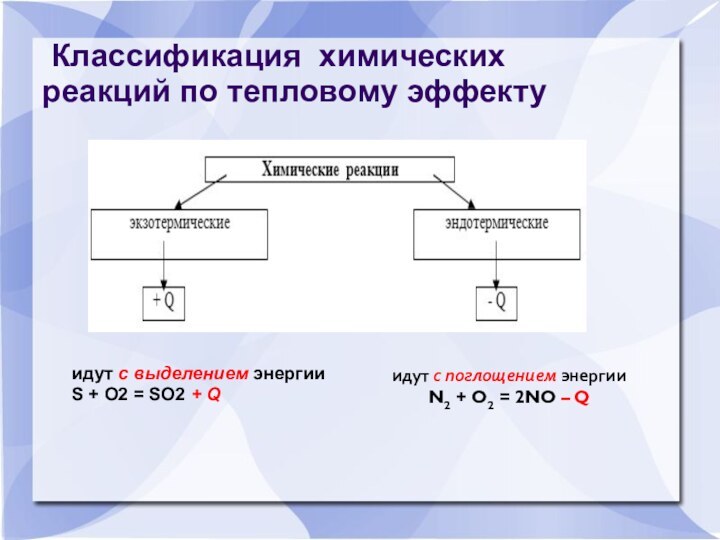
Классификация химических реакций по тепловому эффекту
идут с
выделением энергии S + O2 = SO2 + Q
идут с поглощением энергии
N2 + O2 = 2NO – Q
Слайд 5 Термохимия - раздел химии, в задачу которого входит
определение и изучение тепловых эффектов реакции.
Термохимические уравнения – уравнения
в которых указывается количество поглощенной или выделенной теплоты.2HgO —> 2Hg + O2 – 180 кДж,
С(тв) + O2(г) —> СO2(г) + 394 кДж
Слайд 6 По термохимическим уравнениям реакций можно проводить различные расчёты.
Для решения задач по термохимическим уравнениям реакций нужно записать
само уравнение и провести необходимые расчеты по нему.Алгоритм решения задач по термохимическому уравнению реакции
1. Кратко записать условия задачи (“дано”).
2.Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
3.Провести вспомогательные вычисления ( Мr, М, m).
4.Составить соотношение, используя вспомогательные вычисления и условия задачи; решить соотношение (пропорцию).
5.Записать ответ.