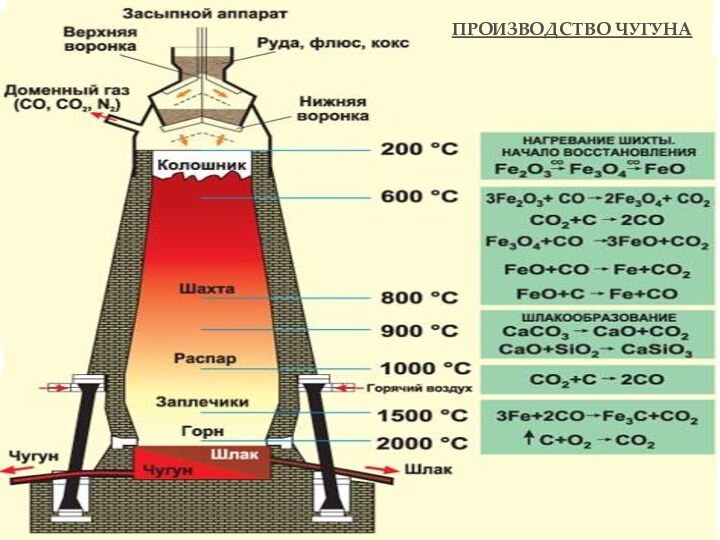
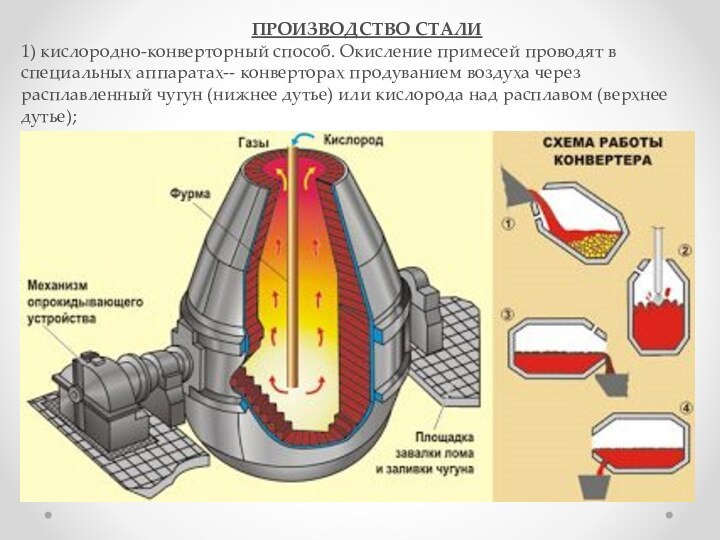
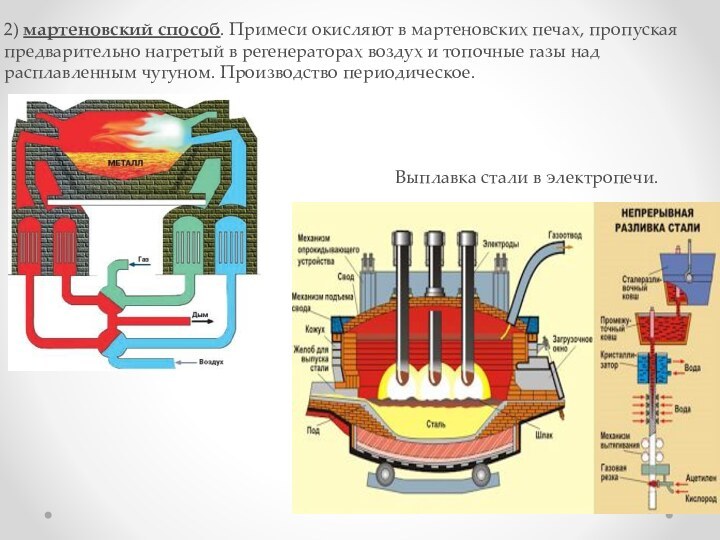
взаимодействии водорода и азота:
N 2 + 3H2 = 2NH3
+ 91,84 кДжДля получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH -> NaCl + NH3 + H2O
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью.
2NH4Cl + Ca(OH)2 -> CaCl2 + 2NH3 + 2H2O