- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Галогены (8 класс)
Содержание
- 2. "О сколько нам открытий чудных готовит просвещенья
- 3. Мы изучим непременно, Элементы галогены (А
- 4. Фамилия - химический знак элемента. Адрес –
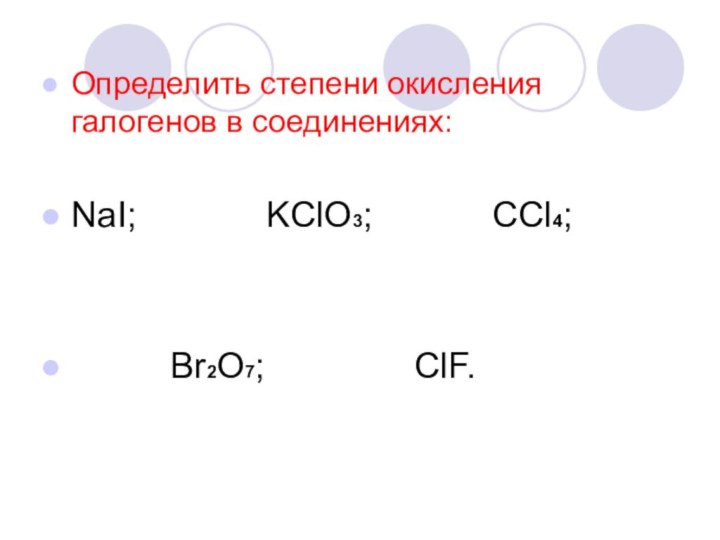
- 7. Определить степени окисления галогенов в соединениях:NaI;
- 8. Получение В промышленности: NaCl → Na +
- 9. Химические свойства1. С металлами:Al + I2 → AlI3
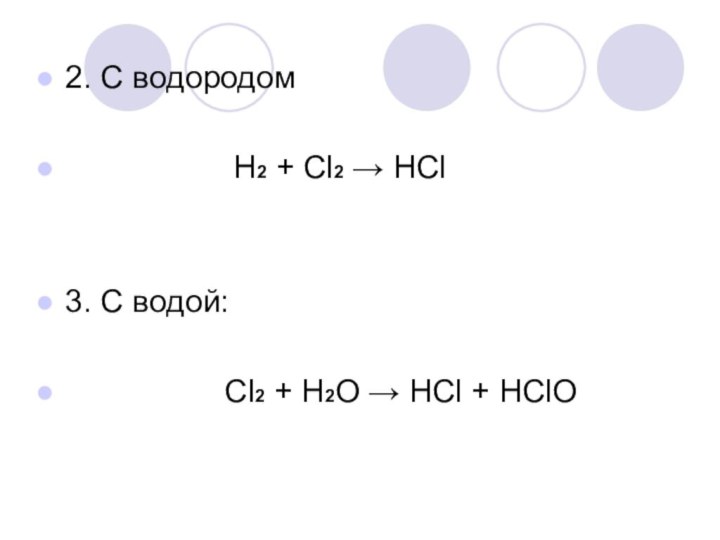
- 10. 2. С водородом
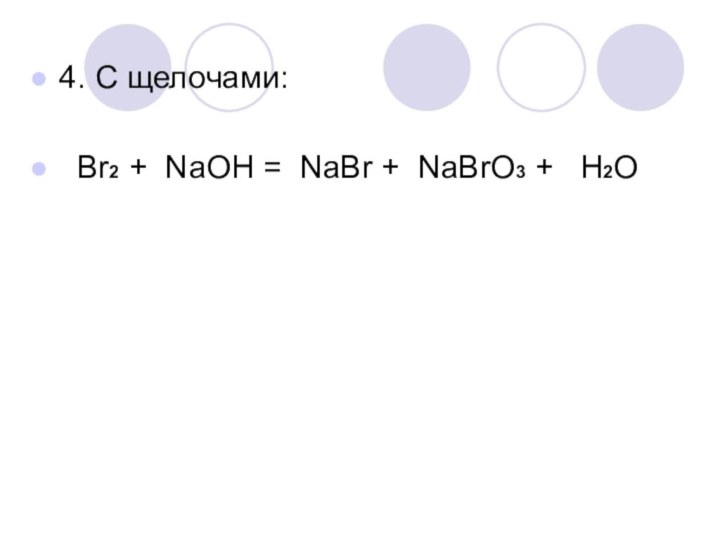
- 11. 4. С щелочами: Br2 + NaOH = NaBr + NaBrO3 + H2O
- 12. Хлор хвалился: “Нет мне равных!”,
- 13. Бром разлился океаном, хоть зловонным,
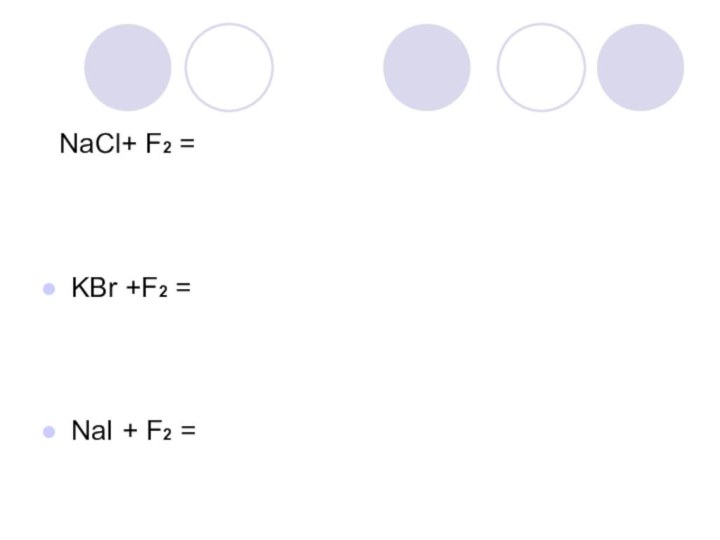
- 15. 3. Опишите наблюдаемые явления.4. Запишите уравнения реакции
- 16. NaCl+ F2 = KBr +F2 = NaI + F2 =
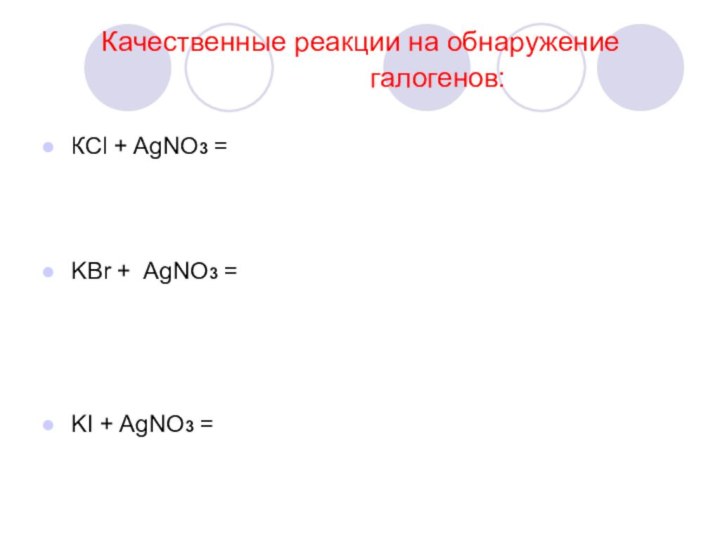
- 17. Качественные реакции на обнаружение
- 18. Скачать презентацию
- 19. Похожие презентации
"О сколько нам открытий чудных готовит просвещенья дух !“ А.С.Пушкин.




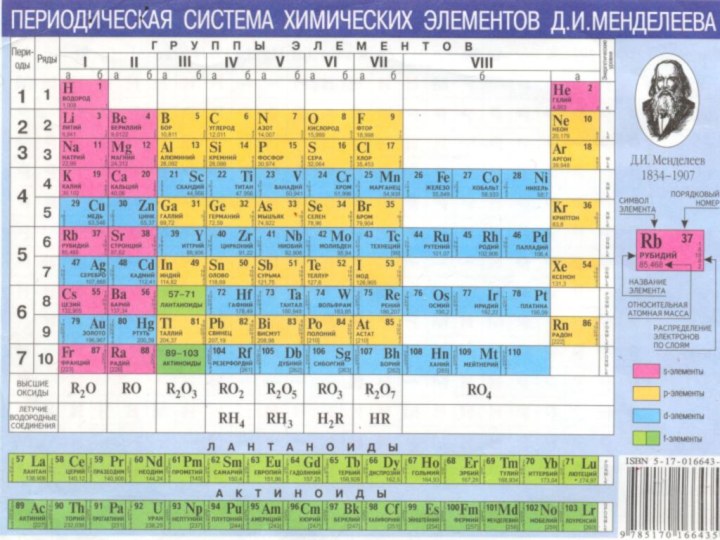







Слайд 3 Мы изучим непременно, Элементы галогены (А по-русски – солероды),
Все от фтора и до йода. Даже новенький астат
Быть в семействе этом рад.
Слайд 4
Фамилия - химический знак элемента.
Адрес – местоположение
в ПС (группа, подгруппа, период, порядковый номер).
Особенности внутреннего
мира – строение его атома (заряд ядра, количество электронов, число энергетических уровней, возможные степени окисления и т.д.).
Слайд 8
Получение
В промышленности:
NaCl → Na + Cl2
В лаборатории:
MnO2+4HCl → MnCl2 + Cl2 +2H2O
2KMnO4 +16HCL =2MnCl2
+5Cl2 +2KCl +8H2O Слайд 12 Хлор хвалился: “Нет мне равных!”, Галоген я
самый главный.
Зря болтать я не люблю:
Все на свете отбелю!”
Йод своей красой гордился, Твердым был, но испарился. Фиолетовый, как ночь, Далеко умчался прочь.
Слайд 13 Бром разлился океаном, хоть зловонным, но -
румяным, Бил себя он грозно в грудь: “Я ведь бром! Не
кто-нибудь…”.Фтор молчал и думал: “Эх!.. Ведь приду – окислю всех ….”
Слайд 14
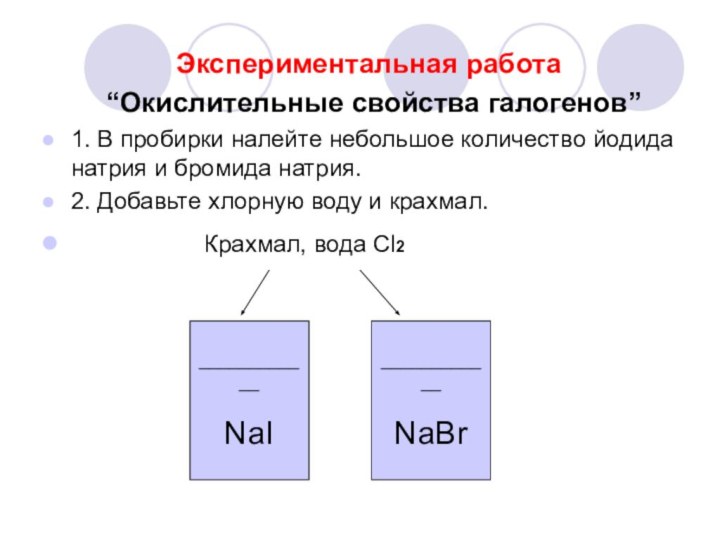
Экспериментальная работа
“Окислительные свойства
галогенов”1. В пробирки налейте небольшое количество йодида натрия и бромида натрия.
2. Добавьте хлорную воду и крахмал.
Крахмал, вода Сl2
____________
NaI
____________
NaBr
Слайд 15
3. Опишите наблюдаемые явления.
4. Запишите уравнения реакции и
составьте СЭБ.
NaI + Cl2 —> …….
NaBr + Cl2 —>
……5. Сделайте вывод.





























