образования" - www.edu-reforma.ru
Соли повсеместно используются как в производстве, так
и в повседневной жизни.Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы гипс (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов — фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений, например, суперфосфата и преципитата.
Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
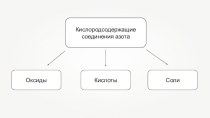
Применение солей