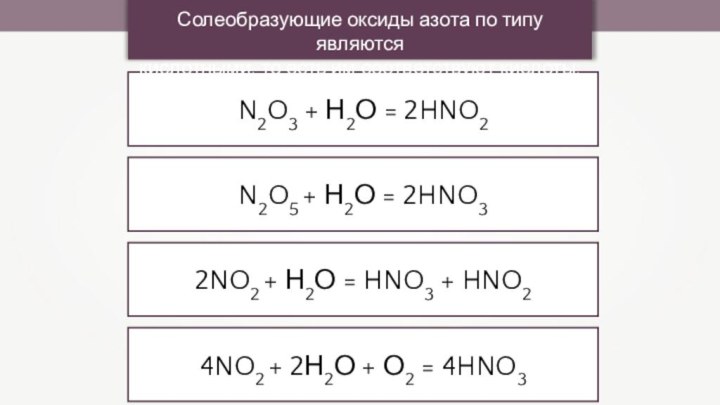
2HNO3
2NO2 + Н2О = HNO3 + HNO2
4NO2 + 2Н2О
+ О2 = 4HNO3Солеобразующие оксиды азота по типу являются
кислотными, то есть им соответствуют кислоты:
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть
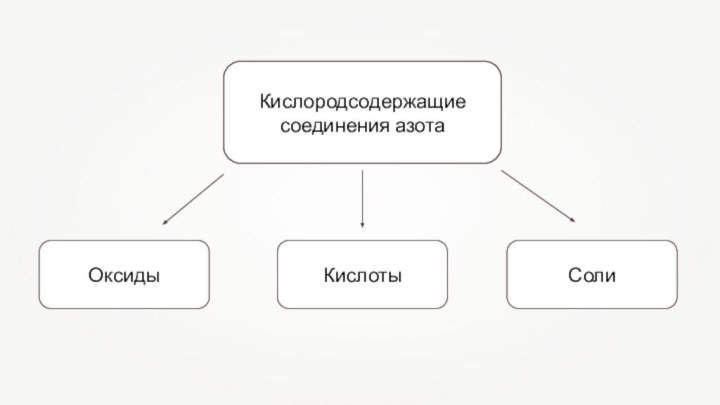
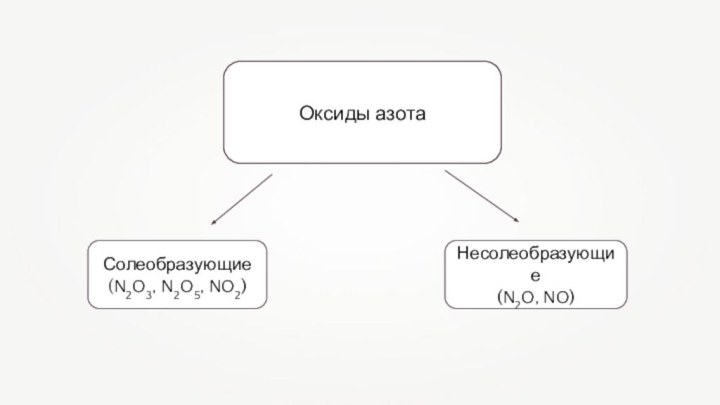










Солеобразующие оксиды азота по типу являются
кислотными, то есть им соответствуют кислоты:
Взаимодействует с основаниями:
HNO3 + NaOH = NaNO3 + H2O
3HNO3 + Al(OH)3 = Al(NO3)3 + 3H2O
Взаимодействует с амфотерными гидроксидами:
Взаимодействует с солями:
2HNO3 + СaCO3 = Са(NO3)2 + Н2О + CO2↑
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2↑ + 2H2O
8HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O