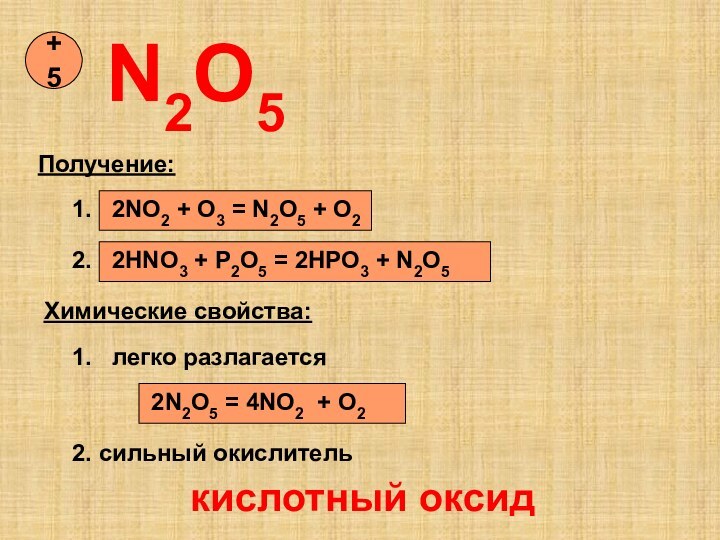
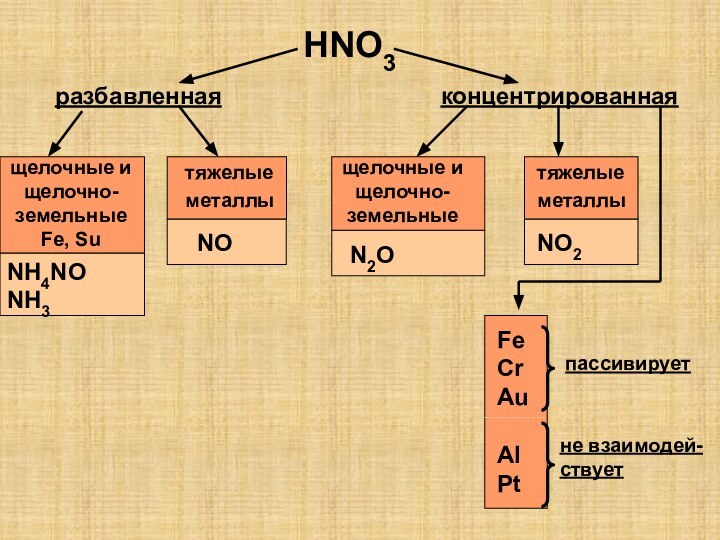
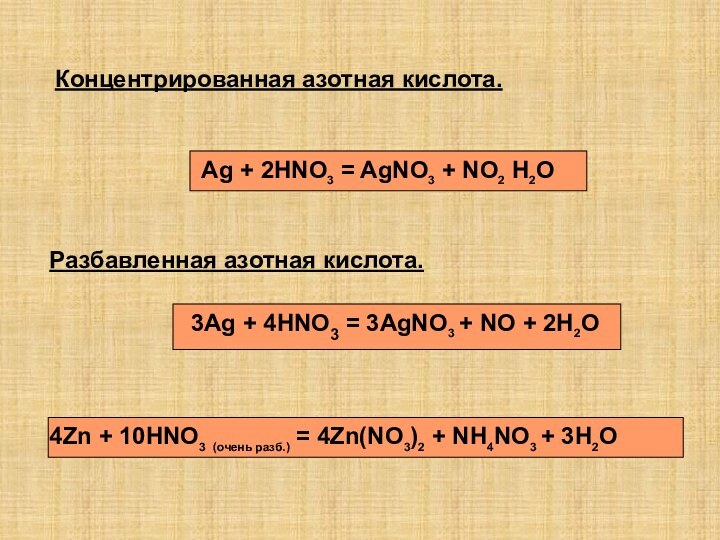
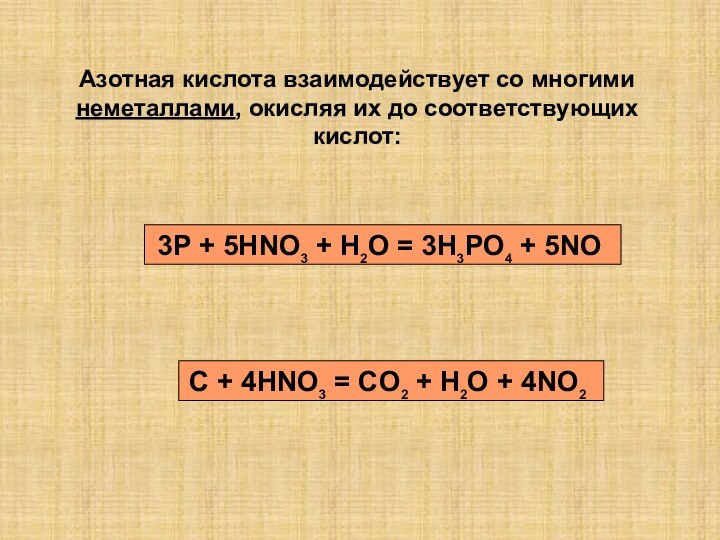
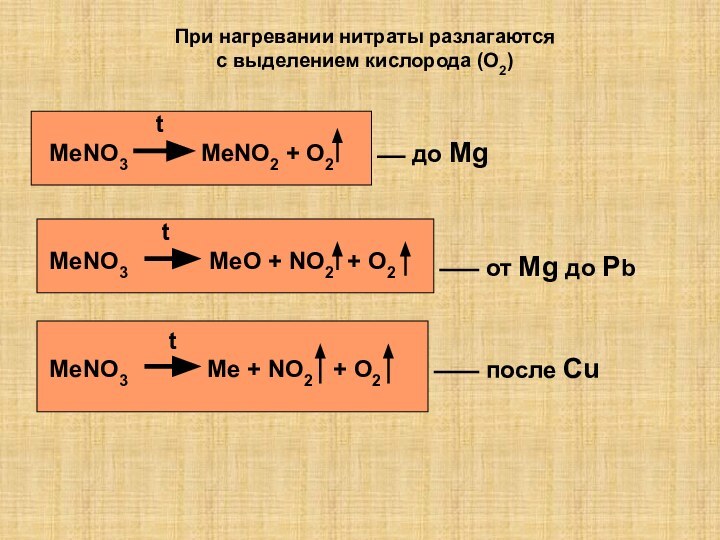
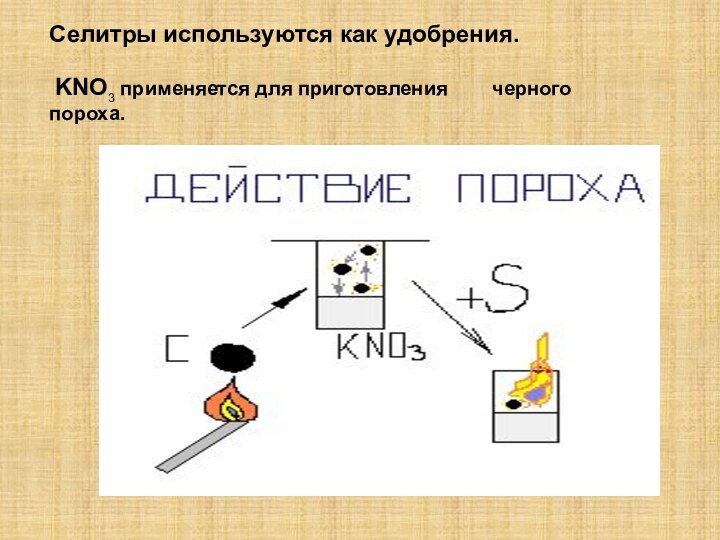
так как она…
1)полностью диссоциирована в водном растворе
2)растворяет даже серебро
3)сильный
окилитель
4)хорошо растворима в воде
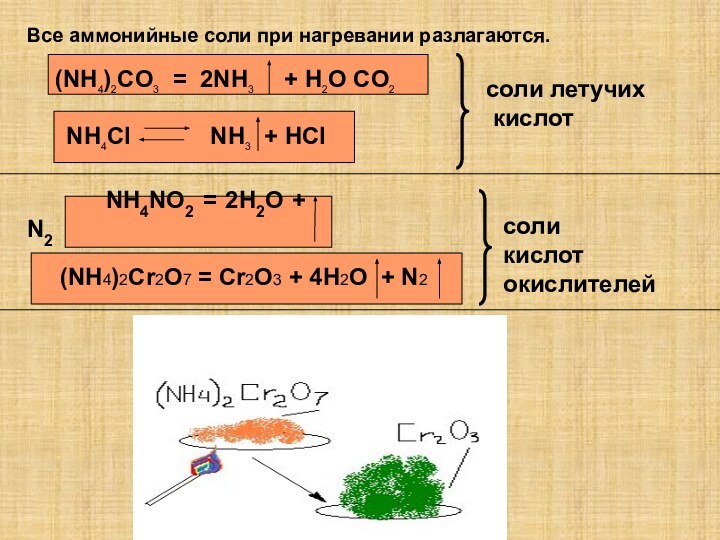
6 Плохо растворяется а воде минеральное удобрение…
1)хлорид аммония
2)нитрат клия
3)сильвинит
4)суперфосфат
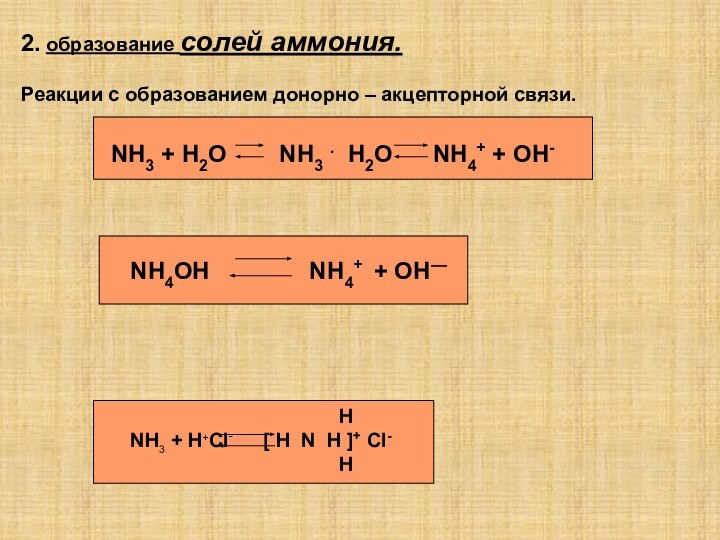
4 соли аммони по по отношению к воде…
1)хорошо растворимы
2)плохо растворимы
3)нерастворимы
4)есть растворимые и нерастворимые
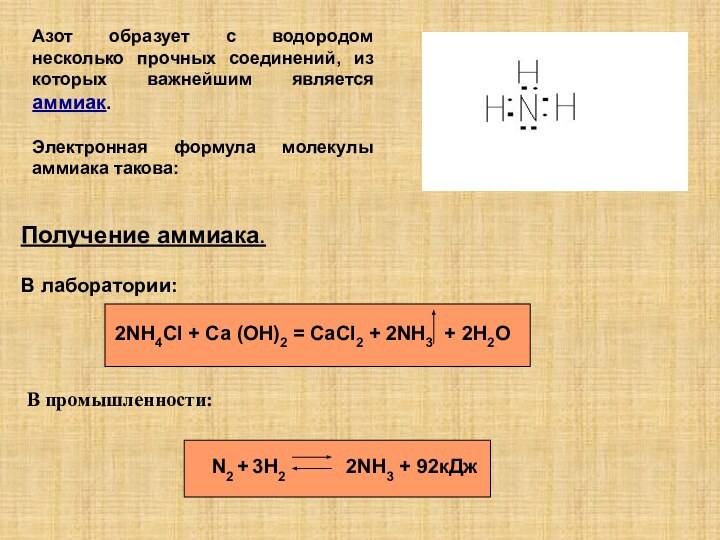
3 аммиак в промышленности получают…
1) N2 + 3H2 2NH3
2) 4NO2 + O2 + 2H2O = 4HNO3
3) N2O5 + H2O = 2HNO3
4) NaNO3(K) + H2SO4(K) = NaHSO4 + HNO3
8 азотной кислоте соответствует оксид…
1) N2O 2) NO 3)NO2 4)N2O5
5 коэффициент перед формулой восстановителя в уравнении реакции
Zn + HNO3 N2O +… + H2O равен
1) 1 2) 2 3) 3 4) 4
2 минимальная степень олисления азота соединении…
1) N2 2) NO 3) NO2 4) HNO3
7 самая слабая из кислот, формула которых
HNO3 2) H2SO4
3) H2CO3 4) H3SiO3
9 из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает:
1) B 2)P 3)N 4)F
10 дополните фразу «нитраты – это …»