Слайд 2
ПЛАН ЛЕКЦИИ:
1. Основные понятия и характеристики
2. Термодинамика процесса
растворения
3. Способы выражения концентрации
4. Идеальные растворы. Законы Рауля.
5.
Свойства сильных и слабых электролитов
6. Произведение растворимости. Константа диссоциации.
7. Ионное произведение воды.
8. Водородный показатель раствора.
Слайд 3
Основные понятия
Дисперсные системы - это смеси различных веществ.
Они состоят из диспергированных веществ и дисперсионной среды и
классифицируются по размерам частиц диспергируемых компонентов.
Слайд 4
В зависимости от размера частиц дисперсные системы подразделяются
на группы:
взвеси (суспензии, эмульсии) – у которых частицы имеют
размер 1000 нм (10–6 м) и более;
коллоидные системы - размеры частиц 1-500 нм
(10–9 ÷5·10–7 м), существуют, если частицы обладают зарядом. Для них характерно рассеяние света (эффект Тиндаля).
Дисперсные системы также классифицируются по агрегатным состояниям дисперсной фазы и дисперсионной среды.
Слайд 5
Истинные растворы –
содержат атомы и молекулы, размеры
которых обычно не превышают 5·10–9 м – это термодинамически устойчивые
однофазные многокомпонентные системы
Слайд 6
Раствором называют гомогенную систему переменного состава, состоящую из
одного или нескольких компонентов.
Всякий раствор состоит из растворителя и
растворенного вещества.
Слайд 7
Растворитель- это тот компонент агрегатное состояние, которого не
изменяется при образовании раствора.
Растворимость- это способность вещества растворяться в
том или ином растворителе.
Слайд 8
Мера растворимости характеризуется коэффициентом растворимости –
Коэффициент растворимости
равен числу граммов растворенного вещества в 100 граммах воды
называется нерастворимым “н”
Если К = 10–3 г/100 г воды – тогда
вещество называется малорастворимым “м”
Если К > 1 г/100 г воды – тогда вещество называется растворимое “р”
Если в таблице растворимости стоит прочерк, значит такие соли в растворе не существуют.
Слайд 10
Для малорастворимых “м” и растворимых “р” веществ значение
растворимости при различных температурах можно найти в справочниках.
Для нерастворимых
“н” веществ мерой растворимости служит величина произведения растворимости – ПР. Значения ПР приведены в справочниках.
Слайд 11
Основные понятия
Произведение растворимости (ПР) – это та часть
вещества которая растворилась и диссоциирует на ионы в растворе.
Слайд 12
Пример:
ПР Аl(OH)3 = 1·10-32
Al(OH)3 → Al3+ + 3OH–
ПР = [Al3+]·[OH–] = 1·10–32
ПР BaSO4 =1,1·10-10
BaSO4 → Ba2+ + SO4 2–
ПР = [Ba2+]·[SO4 2–] = 1,1·10–10,
чем меньше эта величина, тем меньше
растворимость.
Слайд 13
ТЕРМОДИНАМИКА ПРОЦЕССА РАСТВОРЕНИЯ
Слайд 14
Основные положения
Растворение – это физико-химический процесс.
Физическая сторона –
растворяющее вещество теряет свою структуру, разрушается.
Химическая сторона – растворяемое
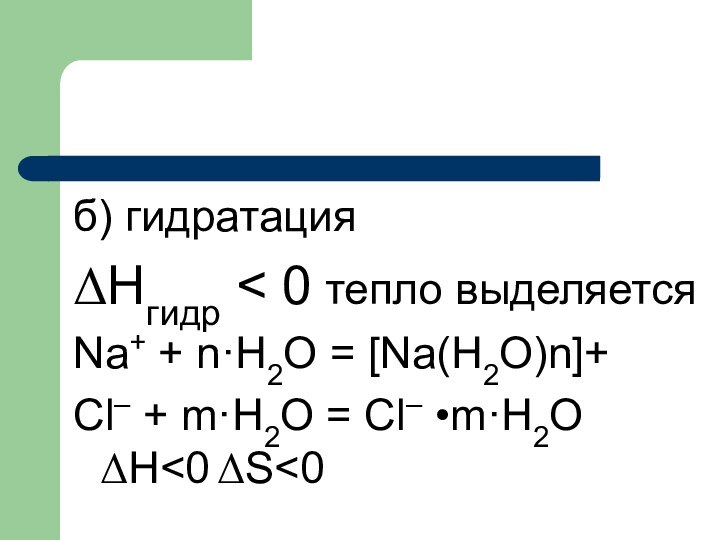
вещество взаимодействует с растворителем- сольватация- образуются сольваты, если растворение идет в воде, то процесс называется гидратацией - образуются гидраты.
Слайд 15
Теплотой или энтальпией растворения – называется количество теплоты,
которое выделяется или поглощается при растворении.
Слайд 16
Что происходит при растворении?
а) разрушение структуры растворенного вещества,
т.е. фазовый переход ΔНфп
ΔНфп > 0 тепло затрачивается
NaClтв = Na+ + Cl– ΔH>0 ΔS>0
Слайд 18
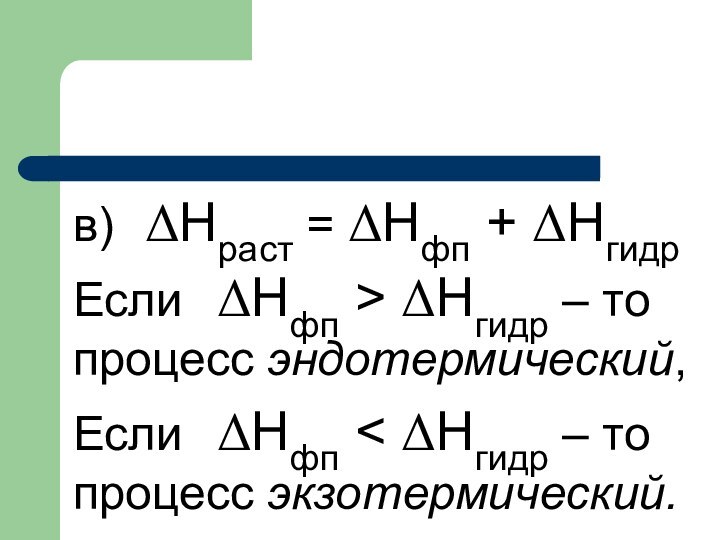
в) ΔHраст = ΔHфп + ΔНгидр
Если ΔHфп > ΔНгидр – то процесс эндотермический,
Если ΔHфп
экзотермический.
Слайд 19
Энтропия растворения
Энтропия растворения твердых и жидких веществ
всегда больше нуля ΔS>0
Энтропия растворения газов ΔS
Слайд 20
Энергия Гиббса
ΔGраств=ΔНраств+Т·ΔSраств
ΔGраств
раствора равна нулю.
Слайд 21
Насыщенный раствор – это раствор который находится в
равновесии с растворяющимся веществом.
Слайд 23
Концентрация раствора – это количество растворенного вещества, содержащегося
в единице массы и объема раствора или растворителя.
Слайд 24
1. Молярная концентрация
Молярная концентрация – характеризует число молей
растворенного вещества в одном литре раствора
Слайд 25
m (р.в.) - масса растворенного вещества, г;
М (р.в.)
– молярная масса растворенного вещества, г/моль;
V – объем раствора,
л.
Слайд 26
2. Молярная концентрация эквивалента или нормальность
Молярная концентрация
эквивалента или нормальность – выражает число моль эквивалентов в
одном литре раствора
Слайд 27
3. Моляльная концентрация
Моляльная концентрация – число моль
растворенного вещества на 1 кг растворителя
Слайд 28
4. Мольная доля
Мольная доля – характеризуется отношением
числа молей компонента к общему числу молей всех компонентов
Слайд 29
5. Массовая доля
Массовая доля – это число
единиц массы растворенного вещества содержащееся в ста единицах массы
раствора
Слайд 30
6. Титр раствора
Титр раствора – масса растворенного
вещества в 1 мл раствора
Слайд 31
ИДЕАЛЬНЫЕ РАСТВОРЫ.
Закон Рауля
Слайд 32
Идеальные растворы – это такие растворы, образование которых
происходит без изменения объема и теплового эффекта.(ΔH=0, ΔV=0), лишь за
счет увеличения энтропии.
Идеальные растворы – это растворы, в которых пренебрегают межмолекулярным взаимодействием.
Слайд 33
В идеальных растворах частицы растворенного вещества находятся на
большом расстоянии друг от друга и их взаимное влияние
можно исключить, а растворитель практически не меняет своих свойств.
Слайд 34
Разбавленные растворы приближаются к идеальным.
Из реальных растворов разбавленные
растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
Слайд 35
Растворы не проводящие электрический ток называются неэлектролитами.
Слабые электролиты
в растворе не диссоциируют на ионы.
Слайд 36
Некоторые физические свойства растворов неэлектролитов зависят только от
концентрации частиц растворенного вещества и природы растворителя и не
зависят от природы растворенного вещества. Эти свойства называются коллигативными свойствами.
Слайд 37
К коллигативным свойствам относятся следующие:
Понижение давления паров
растворителя
Повышение температуры кипения, понижение температуры затвердевания
Осмотическое давление
Слайд 38
1. Понижение давления паров растворителя
Согласно, первому закону Рауля
– относительное понижение давления насыщенного пара растворителя над раствором
пропорционально мольной доле растворенного вещества в растворе
Слайд 39
Р0 – давление насыщенного пара над чистым растворителем;
N
– мольная доля растворенного вещества в растворе.
Слайд 40
ПРИМЕР:
Вычислить давление пара раствора содержащего 45г глюкозы C6H12O6
в 720 граммах воды при 250 С. Давление пара
воды при 250 С составляет 3167 кПа.
Слайд 41
2а. Повышение температуры кипения
Второй закон Рауля:
а) Повышение температуры
кипения ΔТкип раствора пропорционально моляльной концентрации раствора
Слайд 42
Екип – это моляльная константа повышения температуры кипения
растворителя или его эбуллиоскопическая константа, которая зависит от природы
растворителя.
Екип приведена в справочниках.
Слайд 43
ПРИМЕР:
Вычислить температуру кипения 4,6% раствора глицерина в воде.
Молекулярная масса глицерина С3Н8О3 равна 92, Екип для воды
равна 0,52.
Слайд 44
2б. Понижение температуры затвердевания растворов
Второй закон Рауля:
б)
Понижение температуры затвердевания растворов пропорционально моляльной концентрации раствора
Слайд 45
Кзатв – это моляльная константа понижения температуры затвердевания
или криоскопическая константа (для растворителя).
Слайд 46
ПРИМЕР
Вычислить температуру затвердевания раствора состоящего из 100 гр
этиленгликоля С2Н6О2 (М=62) и 900 граммов воды, Кзатв=1,86.
Слайд 47
3. Осмотическое давление
Раствор представляет собой однородную систему.
Частицы
растворенного вещества и растворителя находятся в беспорядочном тепловом движении
и равномерно распределяются по всему объему раствора.
Слайд 48
Молекулы растворителя и растворенного вещества будут диффундировать преимущественно
в том направлении, где их концентрация ниже.
Такая двухсторонняя
диффузия приведет к выравниванию концентраций и С1=С2.
Слайд 49
Однако диффузия бывает односторонней, если растворы разделить полупроницаемой
перегородкой, пропускающей только молекулы растворителя.
При этом условии, что
С2>С1 молекулы растворителя с большей скоростью будут диффундировать в направлении С1⇒С2 и объем раствора с концентрацией С2 несколько возрастет. Такая односторонняя диффузия называется осмосом.
Слайд 50
Для количественной характеристики осмотических свойств вводится понятие осмотического
давления.
Осмотическое давление – это такое давление, которое нужно
приложить, чтобы осмос прекратился. .
Слайд 51
Вант –Гофф предложил, что для осмотического давления можно
применять уравнение состояния идеального газа
Слайд 52
СМ – молярная концентрация раствора. Растворы с одинаковым
осмотическим давлением называются изотоническими.
Слайд 53
ПРИМЕР:
Вычислить осмотическое давление при 270 С раствора сахара
С12Н22О11 (М=342) 1 литр которого содержит 91г сахара.
Слайд 54
СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Слайд 55
Процесс распада вещества на ионы при растворении называется
электролитической диссоциацией.
Количественной характеристикой этого процесса является степень электролитической диссоциации
(α)
Слайд 56
Cтепень электролитической диссоциации (α) - это количество распавшихся
на ионы молекул к общему количеству растворенных молекул.
Слайд 57
По величине α различают:
а) сильные электролиты α > 0,3
б) электролиты средней
силы 0,03
Слайд 58
При диссоциации в растворах слабых электролитов устанавливается равновесие
между недиссоциированными молекулами и продуктами их диссоциации – ионами.
Слайд 59
Пример: диссоциация уксусной кислоты
СН3СООН=СН3СОО– + Н+
В водном растворе устанавливается равновесие
которое количественно характеризуется константой равновесия, иначе константой диссоциации:
Слайд 60
Обозначим концентрации каждого из ионов:
а концентрацию СH3COOH:
Слайд 61
Тогда константу диссоциации запишем:
Слайд 62
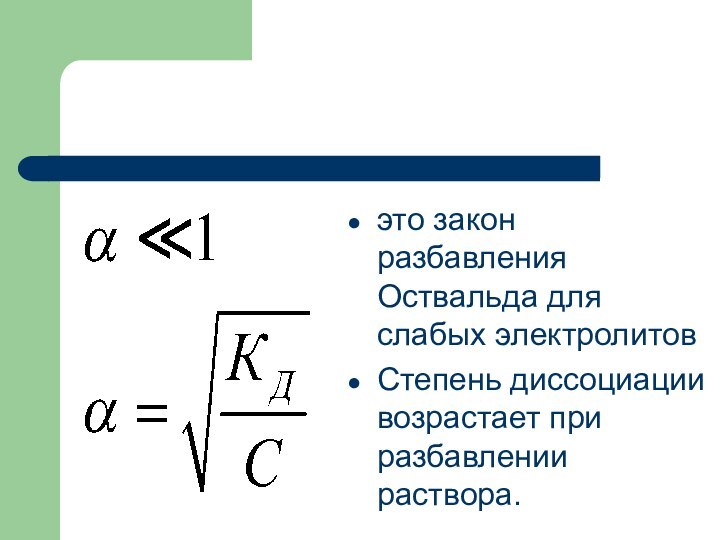
это закон разбавления Оствальда для слабых электролитов
Степень
диссоциации возрастает при разбавлении раствора.
Слайд 63
Сильные электролиты в растворе диссоциируют на ионы.
Рассмотрим примеры
диссоциации кислот, оснований, солей.
Слайд 64
Диссоциация H2SO4
Серная кислота диссоциирует по двум ступеням:
H2SO4 = H+ + HSO4 –
HSO4 – = H+ + SO4 2–
H2SO4 = 2H+ + SO4 2–
Слайд 65
Диссоциация NaOН
NaОH = Na+ + OH–
Слайд 66
Диссоциация солей
KCI = K+ + CI–
Al2(SO4)3 = 2Al3+ + 3SO4 2–
Слайд 67
Экспериментально определяемые для сильных электролитов степени диссоциации называют
кажущимися (αкаж)
как правило αкаж не равно 100% (или
1).
Слайд 68
Диссоциация электролита приводит к тому, что общее число
частиц растворенного вещества молекул и ионов в растворе возрастает
по сравнению с раствором неэлектролита той же молярной концентрации, а коллигативные свойства зависят от концентрации растворенного вещества, то поэтому коллигативные свойства для растворов электролитов сильно отличаются в равных по концентрации растворах неэлектролитов.
Это различие учитывается с помощью изотонического коэффициента ( i )
Слайд 69
Изотонический коэффициент
Это отношение общего числа частиц в растворе
к числу растворенных молекул
В растворах электролитов реально существующее
число частиц > числа растворенных молекул
Поэтому вводится поправочный коэффициент (i), учитывающий изменение числа частиц:
Слайд 70
Изотонический коэффициент (i) – показывает во сколько раз
концентрация частиц в растворе больше числа растворенных молекул.
Тогда коллигативные
свойства для растворов электролитов, будут определятся по формулам с учетом изотонического коэффициента.
Слайд 71
Изотонический коэффициент ( i ) может быть вычислен
как отношение ΔР, ΔТкип, ΔТзатв, Росм, найденных на опыте
к тем же величинам, вычисленным без учета диссоциации электролита:
Слайд 72
Изотонический коэффициент ( i ) и степень электролитической
диссоциации ( α ) связаны между собой соотношением:
n –
число ионов на которые распадается при диссоциации молекула электролита:
KCI = K+ + CI– n=2
Al2(SO4)3 = 2Al3+ + 3SO4 2– n=5
Слайд 73
Пример:
Вычислить осмотическое давление (170С) раствора Na2SO4 в 1
литре которого содержится 7,1 грамма растворенной соли. Кажущаяся степень
электролитической диссоциации соли в растворе равна 0,69 или (69%)
Слайд 75
В насыщенном растворе малорастворимых соединений устанавливается равновесие между
осадком и ионами электролита в растворе
BaSO4 → Ba2+ + SO4 2–KP = ПР = [Ba2+]·[SO4 2–] = 1,1·10–10
Слайд 76
Произведение растворимости
Произведение растворимости равно константе равновесия реакции, равно
произведению молярных концентраций ионов участвующих в равновесии каждая из
которых введена в степень, равную стехиометрическому коэффициенту при соответствующем ионе в уравнении равновесия.
Слайд 77
Пример:
Ca3(PO4)2 = 3Ca2+ + 2PO43-
ПР=[Ca2+]3·[PO43-]2 =Kp
Слайд 78
ПРИМЕР 1.
Растворимость гидроксида магния при 180С равна 1,7*10–4
моль/л. Найти произведение растворимости.
Слайд 79
ПРИМЕР 2
Произведение растворимости СаF2 =3,9·10–11. Какова растворимость СаF2
в воде( в г/литр и молях/литр).
Слайд 80
Условием образования осадка является превышение произведения концентраций ионов
малорастворимого электролита над его произведением растворимости.
Слайд 81
Будет ли образовываться при смешении равных объемов нитрата
свинца с концентрацией 12·10–4 моль/л и сульфата натрия с
концентрацией 8·10–3 .
ПР = [Pb2+]·[SO42-]=1,6·10–8.
Слайд 82
Константа диссоциации воды
Вода - слабый электролит
Н2О =
Н+ + ОН–
Слайд 83
Ионное произведение воды:
1 л. H2O содержит 55,5 моль
H2O
Kд.[H2O] = 1,86.10–16.55,5 =
= [H+].[OH–] = 10–14 =
Кw
Кw не зависит от концентрации ионов
Слайд 84
Водородный показатель
Кислотность или основность водных растворов характеризуется
концентрацией [Н+] или [ОН–] ионов
Удобнее использовать логарифмическое выражение:
рН
= - lg [H+] и pOH = - lg [OH–]
Для воды [Н+] = [ОН–] = 10–7
рН = рОН = 7 - нейтральная среда











![Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Пример:ПР Аl(OH)3 = 1·10-32 Al(OH)3 → Al3+ + 3OH– ПР = [Al3+]·[OH–] = 1·10–32ПР BaSO4 =1,1·10-10 BaSO4 → Ba2+ + SO4 2– ПР = [Ba2+]·[SO4 2–] = 1,1·10–10, чем](/img/tmb/15/1464520/bc8597b1c7bac18cf21e92fb7bd39e91-720x.jpg)

















































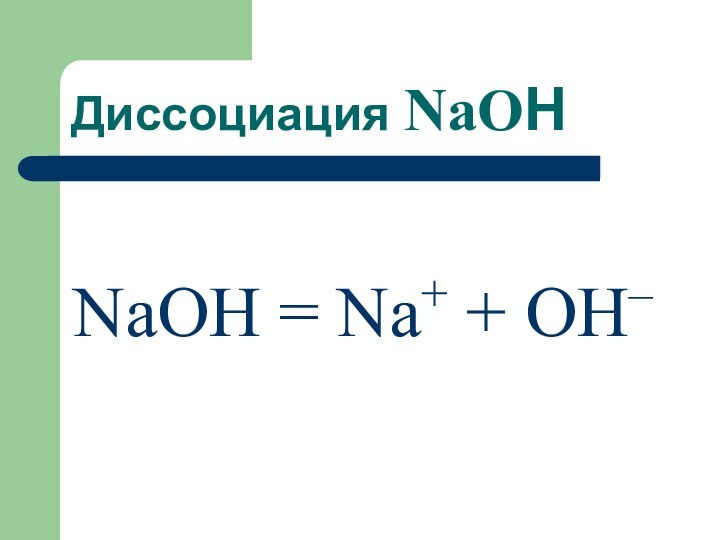











![Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Пример:Ca3(PO4)2 = 3Ca2+ + 2PO43-ПР=[Ca2+]3·[PO43-]2 =Kp](/img/tmb/15/1464520/44b4d5d392d926f134a783901574cce5-720x.jpg)





![Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Ионное произведение воды:1 л. H2O содержит 55,5 моль H2O Kд.[H2O] = 1,86.10–16.55,5](/img/tmb/15/1464520/010a156888dfb89f76b6a893c98ab213-720x.jpg)
![Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Водородный показатель Кислотность или основность водных растворов характеризуется концентрацией [Н+] или [ОН–]](/img/tmb/15/1464520/a6cfe363fc7ebae3f6c9c1231d3762d7-720x.jpg)
![Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Если в растворе: [Н+] > [ОН–], то рН < 7, а рОН](/img/tmb/15/1464520/e6c58545cfa5e3774d643690398a2747-720x.jpg)