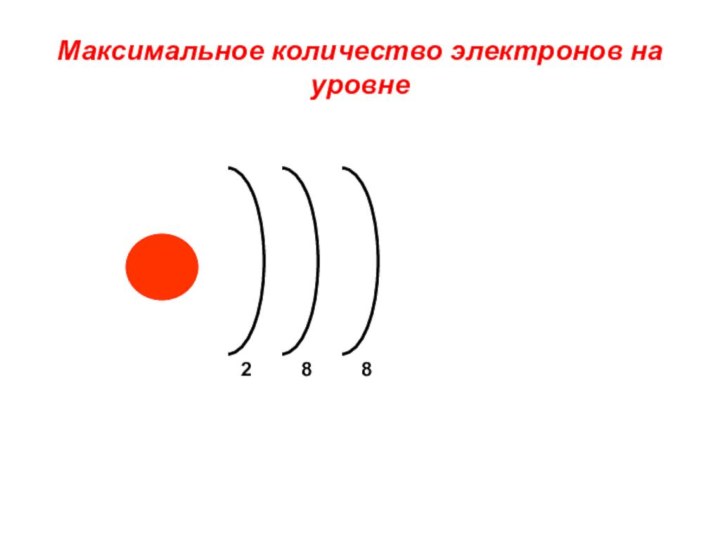
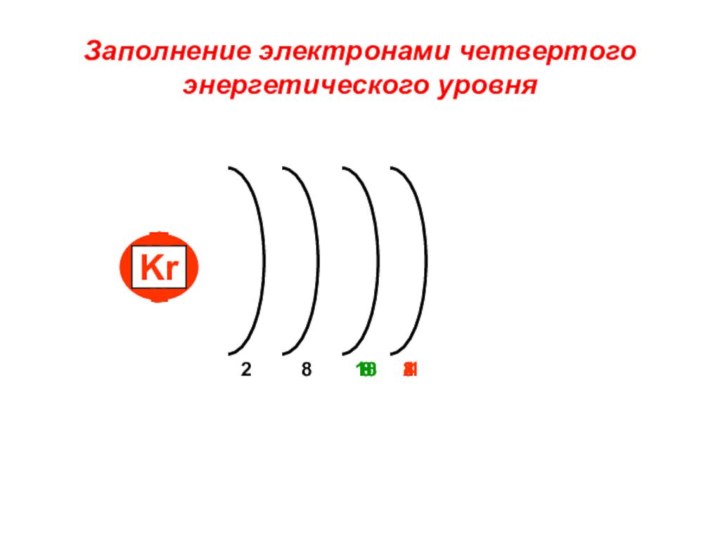
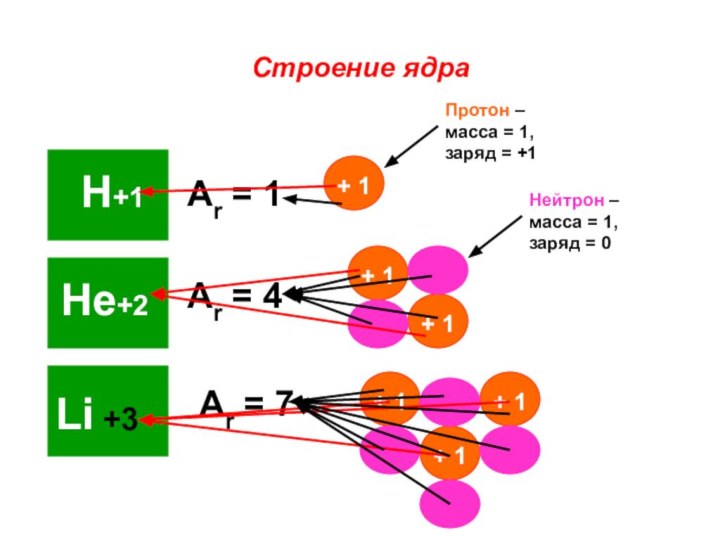
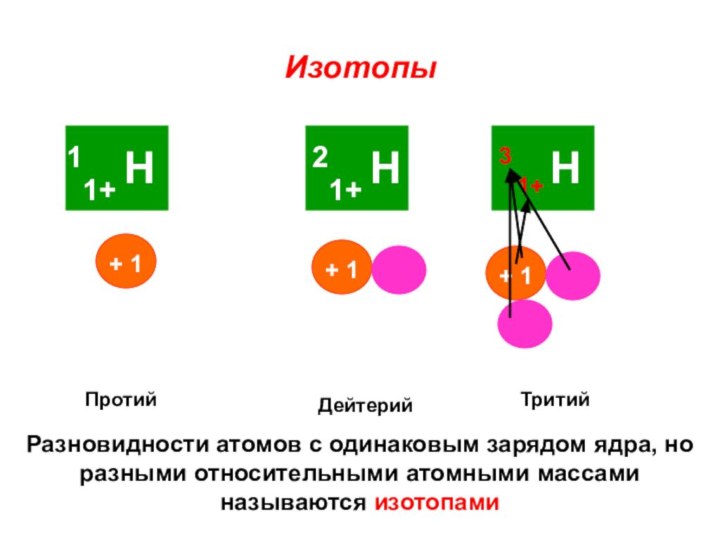
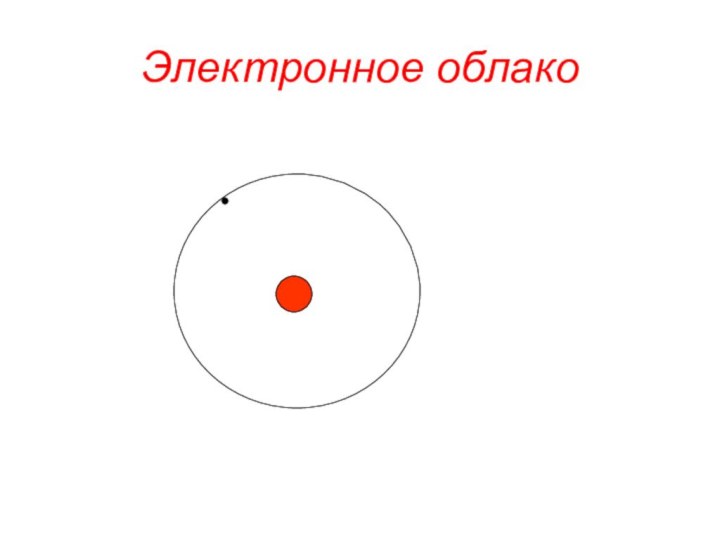
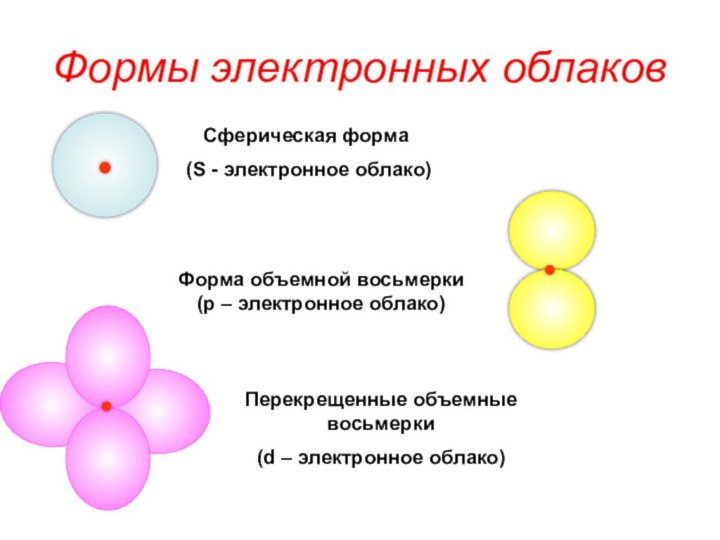
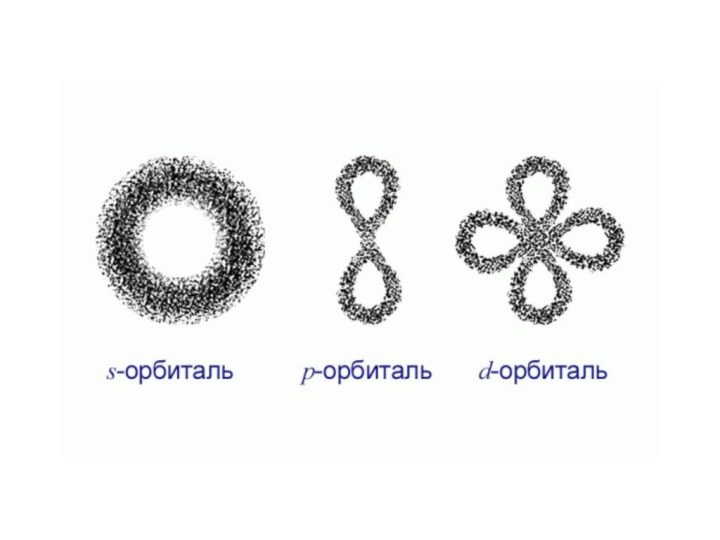
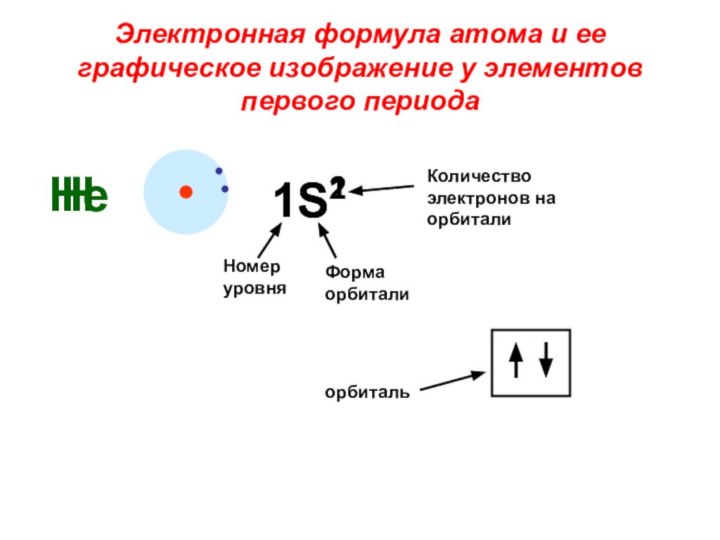
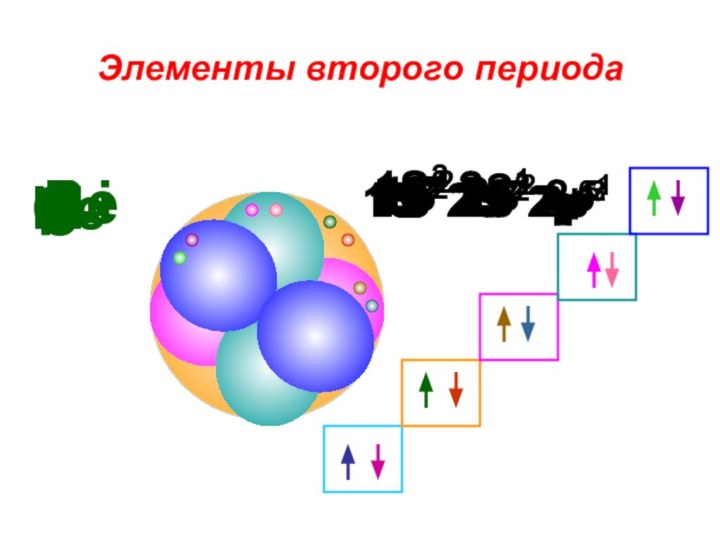
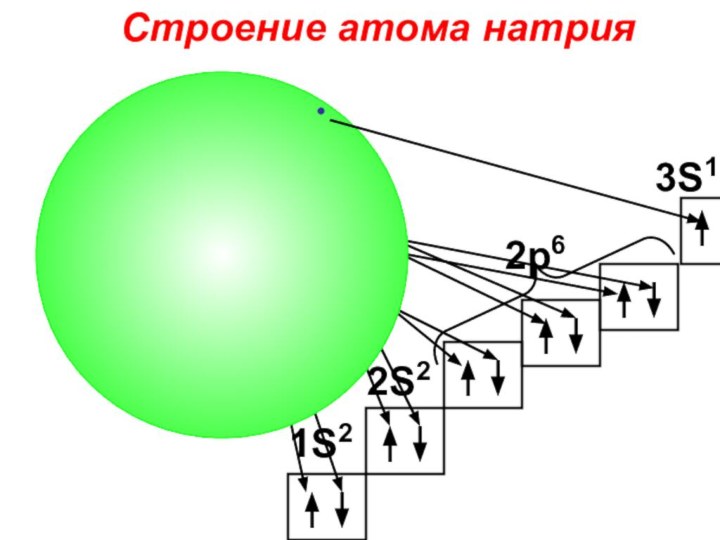
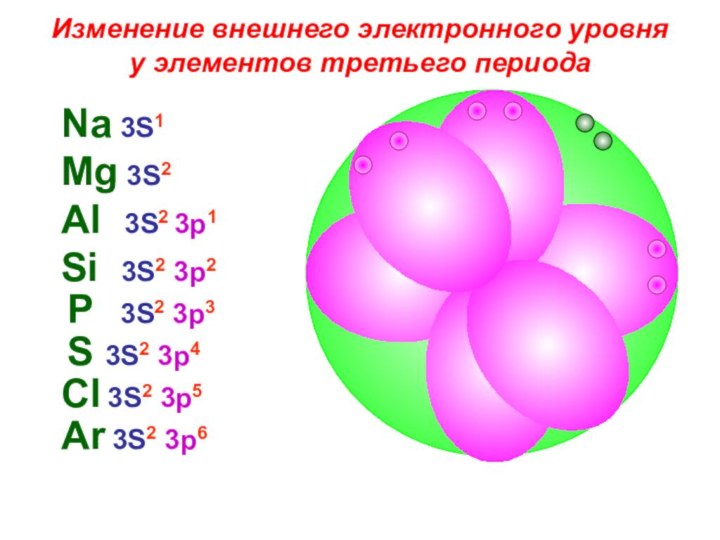
«s-орбиталь»,
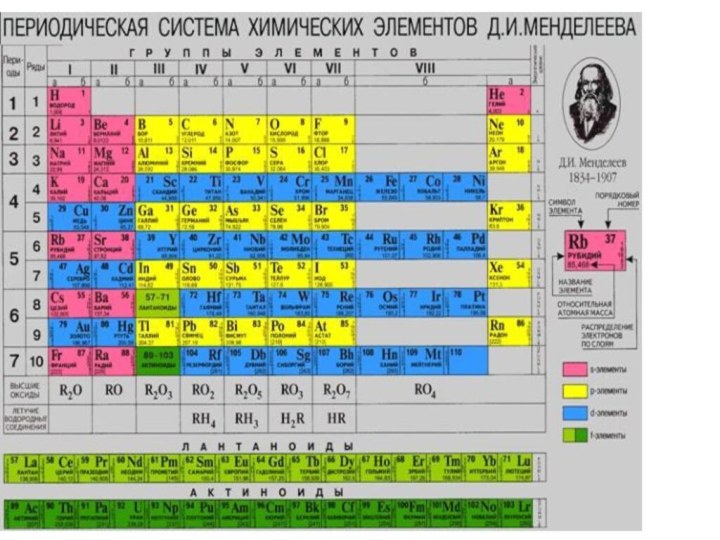
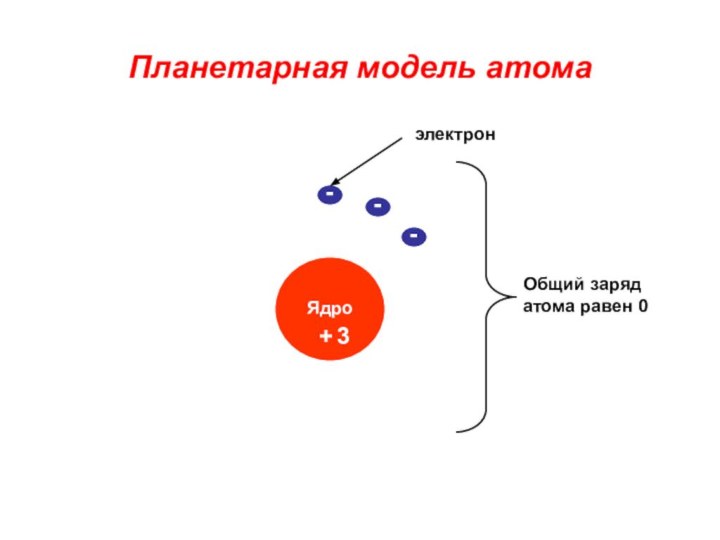
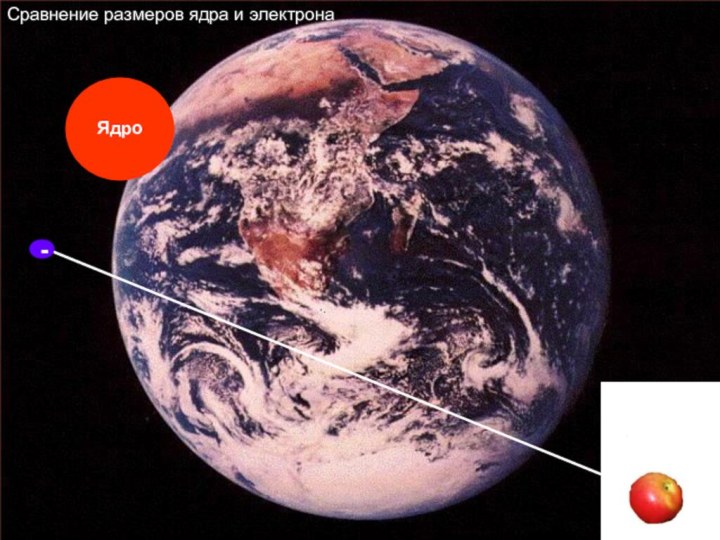
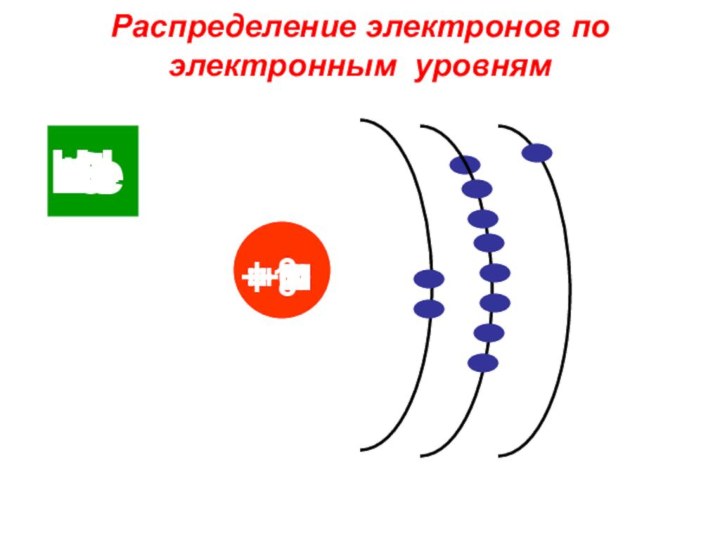
«p-орбиталь», «электронное строение атома», Периодический закон и Периодическую систему Д. И. Менделеева;закономерности изменения химических элементов в главных подгруппах и периодах от заряда их ядер;
закрепить навыки написания электронных конфигураций атомов химических элементов I-III периодов
Наши задачи сегодня на уроке: