Слайд 2
Инструкция. Как составить опорный КОНСПЕКТ
Опорный
конспект – это сокращенная символическая запись изучаемого материала, в
которой сжато изображены основные смысловые вехи изучаемой темы.
Составить такую «шпаргалку» - значит проработать весь необходимый материал, структурировать свои знания, «разложить все по полочкам».
Главное условие: краткость, наглядность, минимум текстовой информации. Новые термины целесообразно записывать полностью.
Слайд 3
Причиной эффекта собачьей пещеры в Италии является оксид
углерода СО2. Он тяжелее воздуха, поэтому получается так, что
газ в пещере как раз покрывает собачью голову. Невысокие животные гибнут от удушья за несколько минут. А за счёт своего роста человек может легко пройти по ней.
Слайд 4
Кислотные дожди появляются, когда с атмосферным кислородом и
водяным паром соединяются оксиды серы и азота. Эти оксиды
выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.
Слайд 5
Известно около 300 оксидов. Из железных руд, содержащих
оксиды железа, получают железо.
Песок, состоящий преимущественно состоит из SiO2,
используют при производстве стекла.
Некоторые оксиды являются основой для красок: ZnO – белой, Fe2O3 – коричневой, Cr2O3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.
Слайд 6
Что общего из приведенных оксидов?
Слайд 7
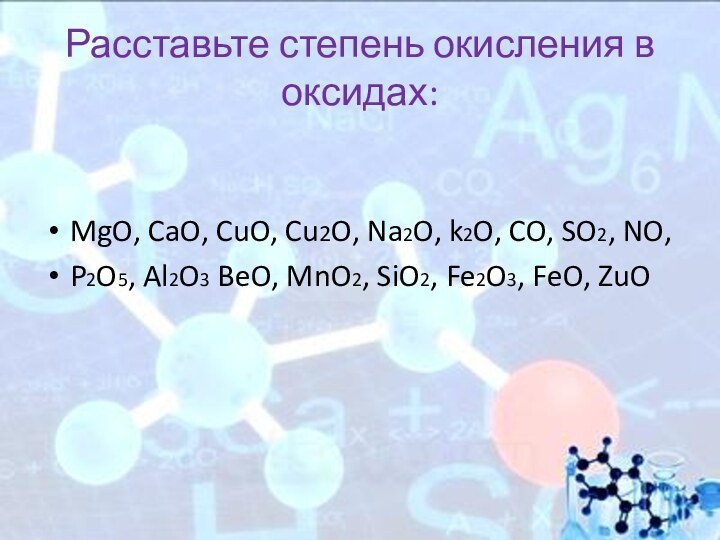
Расставьте степень окисления в оксидах:
MgO, CaO, CuO, Cu2O,
Na2O, k2O, CO, SO2, NO,
P2O5, Al2O3 BeO, MnO2, SiO2,
Fe2O3, FeO, ZuO
Слайд 9
Продолжаем составлять конспект.
Слайд 10
Напишите формулы оксидов и наоборот дайте название.
Оксид серы
(IV), оксид фосфора(V), оксид углерода(IV), оксид серы(VI)
MgO, CaO, CuO,
Cu2O, Na2O, k2O, CO, SO2, NO, P2O5, Al2O3, BeO, MnO2, SiO2, Fe2O3, FeO, ZuO
Слайд 11
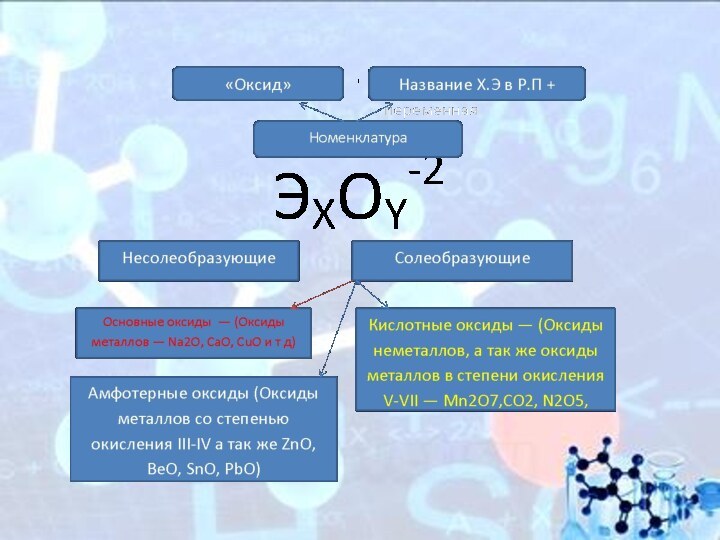
Классификация оксидов
Все оксиды, по способности образовать соли, можно
разделить на две группы:
Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и
т. д.)
Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
Основные оксиды — (Оксиды металлов — Na2O, CaO,CuO)
Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Слайд 13
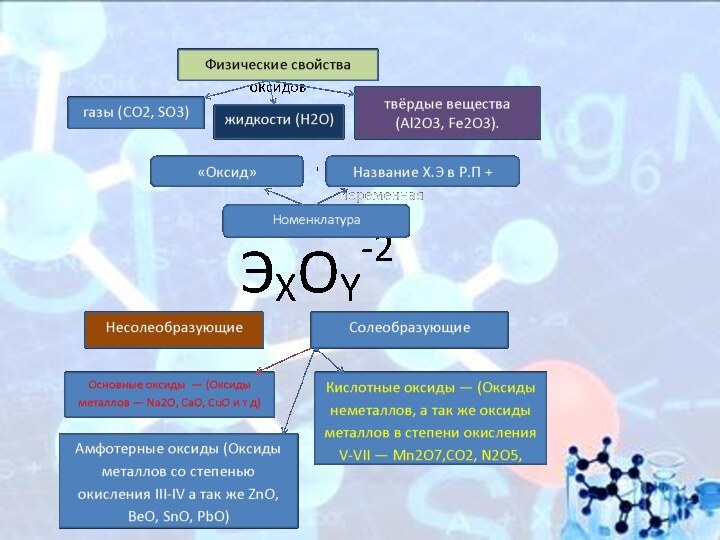
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим
свойствам. Они могут быть как жидкостями (Н2О), так и
газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).