- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему сера
Содержание
- 2. История открытия«Греческий огонь» (Х в. н.э.)
- 3. История открытияАнтуан Лоран Лавуазье(1743 - 1794 г.)Эйльхард Мичерлих(1794 – 1863 г.)
- 4. Нахождение в природе. В свободном виде.Ромбическая сера S8
- 5. Нахождение в природе. В соединениях.FeS2 –Пирит CuS –Медный блеск
- 6. Нахождение в природе. В соединениях.PbS -Свинцовый блескCaSO4*2H2O –Сульфат гипса
- 7. Нахождение в природе. В соединениях.Na2SO4*10H2O -Мирабилит Sb2S3 –Антимонит
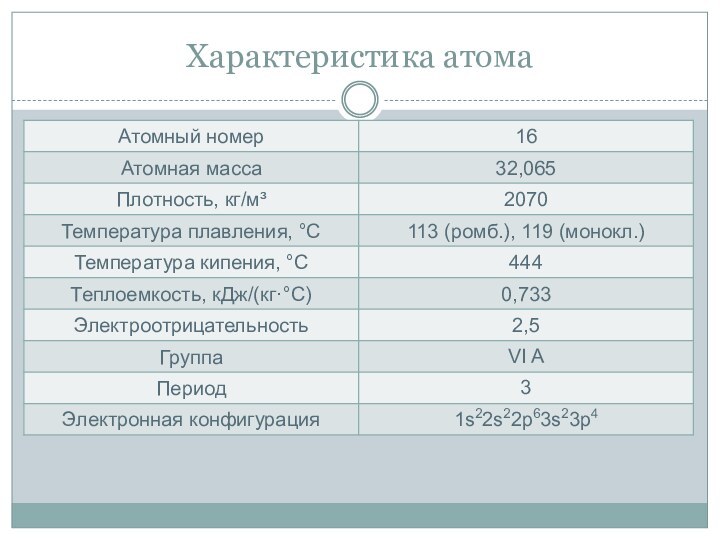
- 8. Характеристика атомаВалентность: II; IV; VIС.о.: -2; 0; +2; +4; +6
- 9. Характеристика атома
- 10. Аллотропные модификации серыМоноклинная сераПластическая сера
- 11. Получение.В промышленностиВыплавление из горных пород
- 12. Химические свойства. Взаимодействие с простыми веществамиtotototo
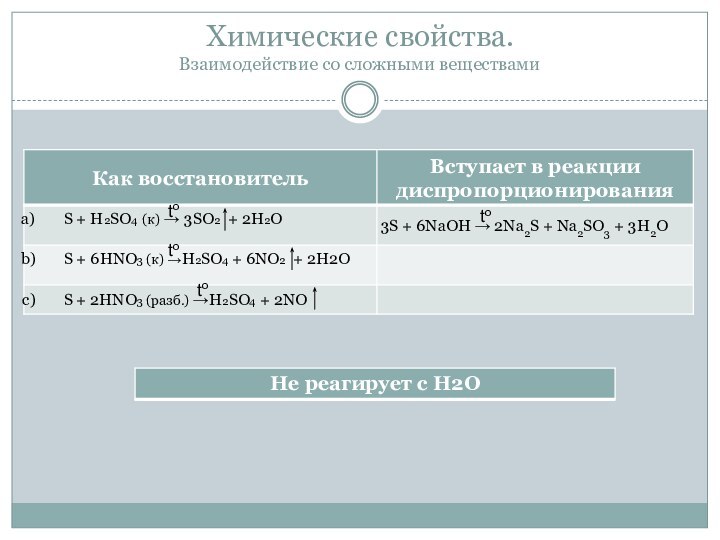
- 13. Химические свойства. Взаимодействие со сложными веществамиtotototo
- 14. ПрименениеВ сельском хозяйствеВ бумажной промышленностиВ резиновой промышленностиДля
- 15. H2S – сероводородХарактеристика и свойстваБесцветный газ с неприятным запахомЯдовитРастворим в водеСлабая кислота(двухосновная)Диссоциирует в две ступени
- 16. Получение. H2 + S → H2SВытеснение сероводорода из сульфидов сильными кислотами
- 17. Диссоциация.Диссоциация происходит в 2 ступени: H2S → H+ + HS- HS- → 2H+ + S2-
- 18. Химические свойства!! Только восстановитель2H2S + O2(недост) →
- 19. SO2 – сернистый газХарактеристика и свойстваБесцветный газ с резким запахомЯдовитТяжелее воздухаХорошо растворим в воде
- 20. Получение.1. В промышленности: обжиг сульфидов
- 21. Химические свойстваSO2 + H2O ↔ H2SO32NaOH +
- 22. SO3 – серный ангидридХарактеристика и свойстваБесцветная жидкостьПри температуре
- 23. Получение.В промышленности 2SO2 + O2
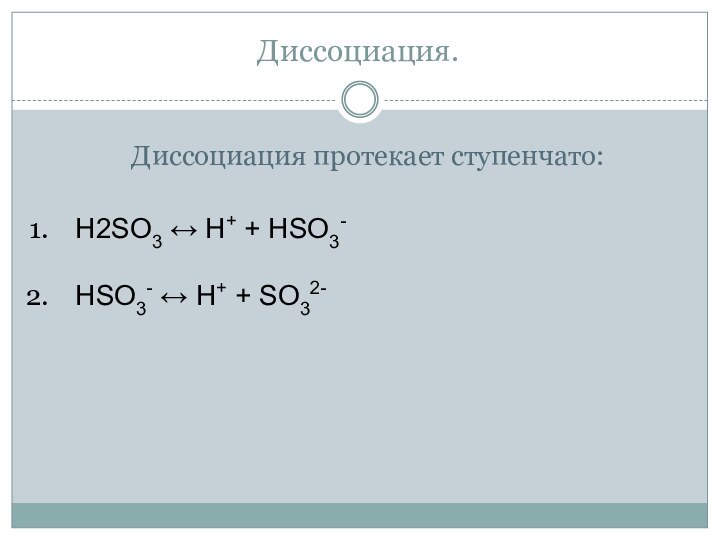
- 24. Диссоциация.Диссоциация протекает ступенчато:H2SO3 ↔ H+ + HSO3- HSO3- ↔ H+ + SO32-
- 25. Химические свойстваSO3 + H2O → H2SO42NaOH +
- 26. H2SO4 – серная кислотаХарактеристика и свойстваТяжелая масляная
- 27. Получение.4FeS2 + 11O2 → 2Fe2O3 + 8SO22SO2
- 28. Диссоциация.Диссоциация протекает ступенчато:H2SO4→ H+ + HSO4- HSO4- →
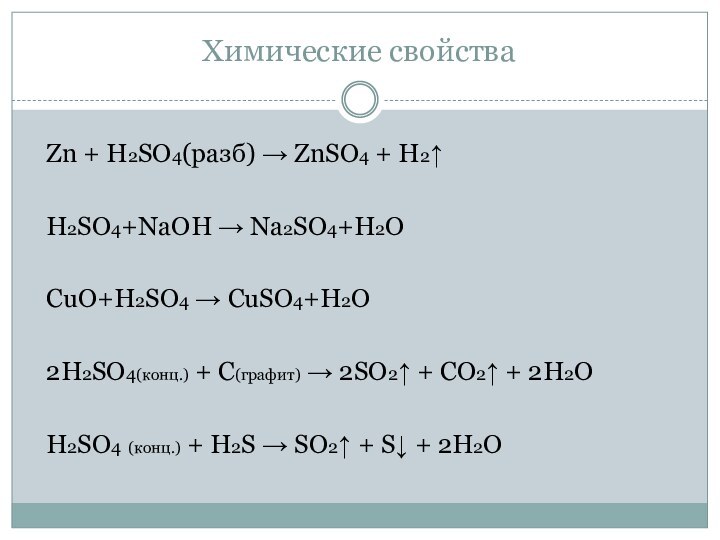
- 29. Химические свойстваZn + H2SO4(разб) → ZnSO4 + H2↑H2SO4+NaOH →
- 30. Скачать презентацию
- 31. Похожие презентации
История открытия«Греческий огонь» (Х в. н.э.)






















Слайд 11
Получение.
В промышленности
Выплавление из горных пород
FeS2 → FeS + S (без доступа воздуха)
В
лаборатории2H2S + O2 → 3S + 2Н2О
H2SO3 + 2H2S → 3S + 3H2O
to
Слайд 14
Применение
В сельском хозяйстве
В бумажной промышленности
В резиновой промышленности
Для получения
черного (охотничьего) пороха
В производстве спичек
Лечение кожных заболеваний
Производство серной
кислоты
Слайд 15
H2S – сероводород
Характеристика и свойства
Бесцветный газ с неприятным
запахом
Ядовит
Растворим в воде
Слабая кислота(двухосновная)
Диссоциирует в две ступени
Слайд 18
Химические свойства
!! Только восстановитель
2H2S + O2(недост) → 2S
+ 2H2O
2H2S + 3O2(изб) → 2SО2 + 2H2O
H2S +
Ca → CaS + H2H2S + CaO→ CaS + H2O
H2S + 2NaOH→ Na2S + 2H2O
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
H2S + Br2 → S + 2HBr
Качественная реакция на сероводородную кислоту:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
(черный)
Слайд 19
SO2 – сернистый газ
Характеристика и свойства
Бесцветный газ с
резким запахом
Ядовит
Тяжелее воздуха
Хорошо растворим в воде
Слайд 20
Получение.
1. В промышленности: обжиг сульфидов
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2. В
лаборатории:Горение серы
S + O2 → SO2↑
Действие кислот на соли сернистой кислоты
Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O
При окислении тяжелых металлов концентрированной серной кислоты
Cu + 2H2SO4(к) → CuSO4 + SO2 + 2H2O
to
to
to
to
Слайд 21
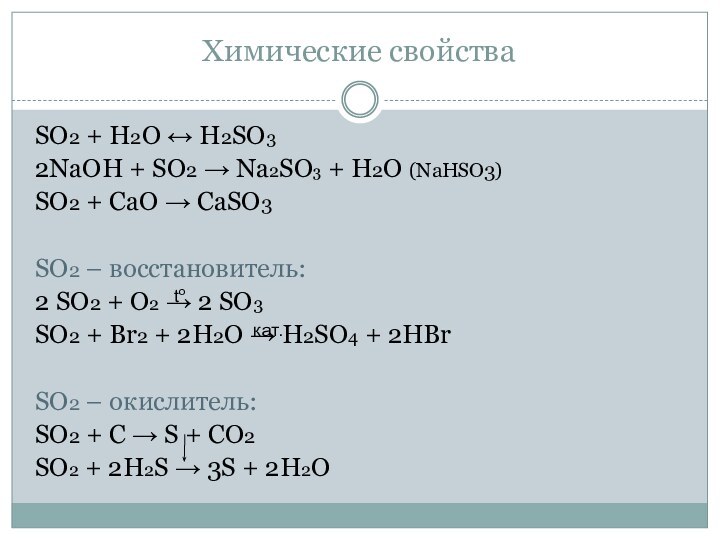
Химические свойства
SO2 + H2O ↔ H2SO3
2NaOH + SO2
→ Na2SO3 + H2O (NaHSO3)
SO2 + CaO → CaSO3
SO2
– восстановитель:2 SO2 + O2 → 2 SO3
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
SO2 – окислитель:
SO2 + С → S + СO2
SO2 + 2H2S → 3S + 2H2O
to
кат.
Слайд 25
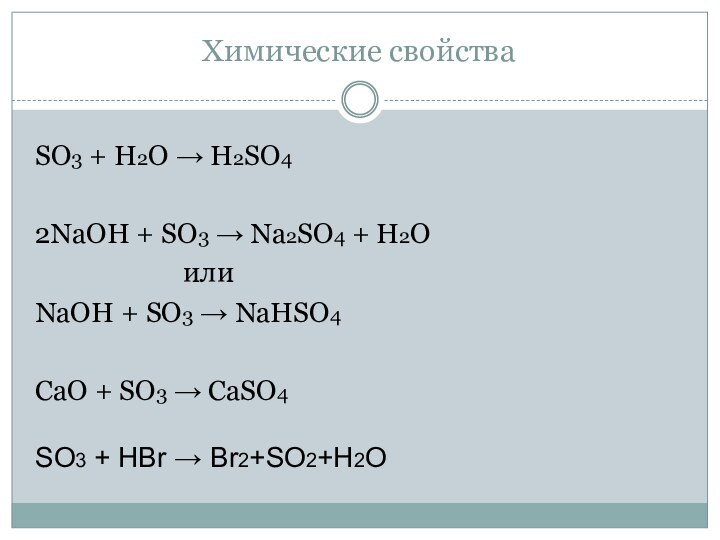
Химические свойства
SO3 + H2O → H2SO4
2NaOH + SO3
→ Na2SO4 + H2O
илиNaOH + SO3 → NaHSO4
CaO + SO3 → CaSO4
SO3 + HBr → Br2+SO2+H2O
Слайд 26
H2SO4 – серная кислота
Характеристика и свойства
Тяжелая масляная жидкость
Не
имеет цвета и запаха
Гигроскопична
Растворима в воде(вливать кислоту в воду)
Слайд 27
Получение.
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 +
O2 → 2SO3
nSO3 + H2SO4(к) → (H2SO4 • nSO3)
(олеум)H2SO4 • nSO3 + H2O → H2SO4
to
V2O5
to
Слайд 28
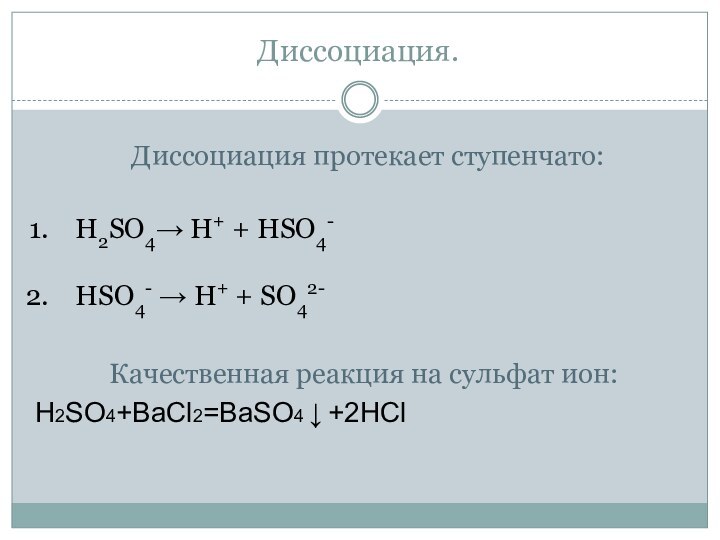
Диссоциация.
Диссоциация протекает ступенчато:
H2SO4→ H+ + HSO4-
HSO4- → H+
+ SO42-
Качественная реакция
на сульфат ион:H2SO4+BaCl2=BaSO4 ↓ +2HCl
Слайд 29
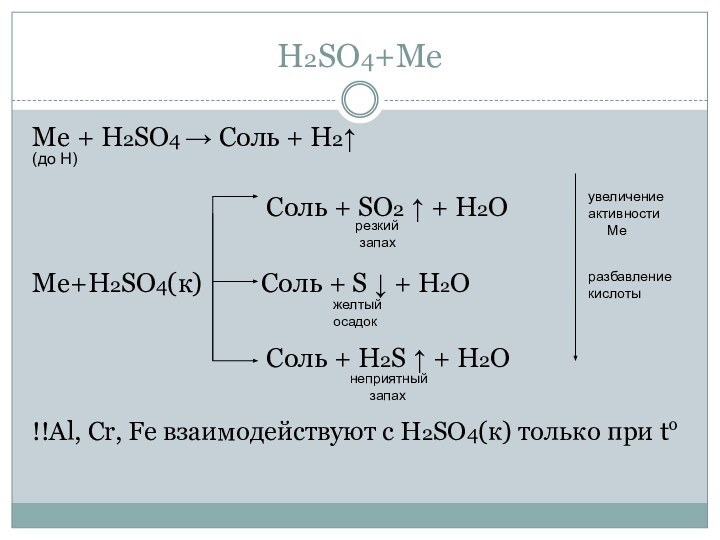
Химические свойства
Zn + H2SO4(разб) → ZnSO4 + H2↑
H2SO4+NaOH → Na2SO4+H2O
CuO+H2SO4
→ CuSO4+H2O
2H2SO4(конц.) + C(графит) → 2SO2↑ + СO2↑ +
2H2OH2SO4 (конц.) + H2S → SO2↑ + S↓ + 2H2O