Слайд 2
ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
В медицине активно разрабатываются и используются соединения,
изменяющие активность ферментов с целью регуляции скорости метаболических реакций
и уменьшения синтеза определенных веществ в организме.
Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно.
Ингибитор – это вещество, вызывающее специфичное снижение активности фермента.
Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, т.к. снижают активность любых ферментов, т.е. неспецифично.
1. По прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым.
2. По отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
Слайд 3
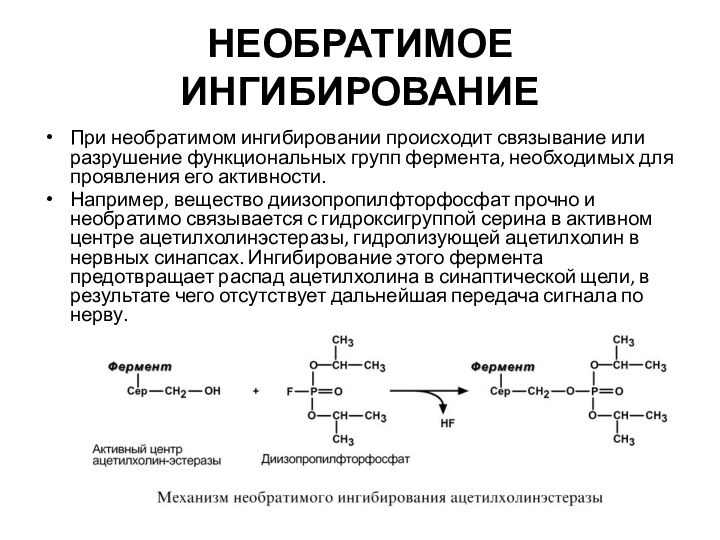
НЕОБРАТИМОЕ ИНГИБИРОВАНИЕ
При необратимом ингибировании происходит связывание или разрушение
функциональных групп фермента, необходимых для проявления его активности.
Например, вещество
диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего отсутствует дальнейшая передача сигнала по нерву.
Слайд 4
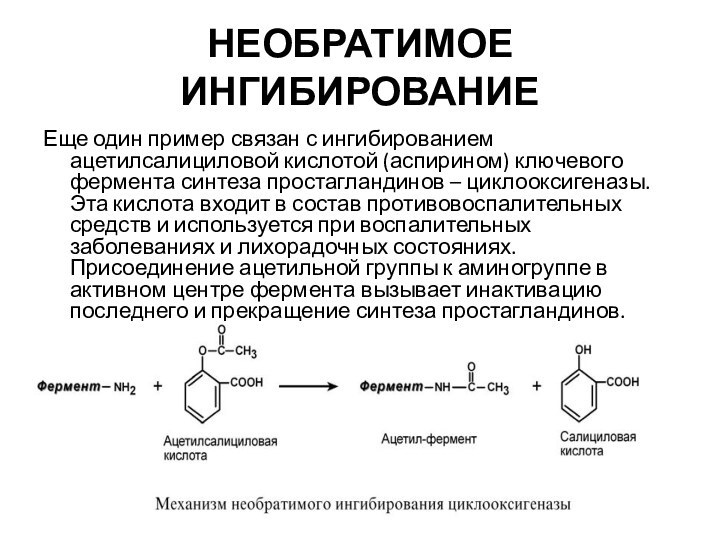
Еще один пример связан с ингибированием ацетилсалициловой кислотой
(аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота
входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к аминогруппе в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
НЕОБРАТИМОЕ ИНГИБИРОВАНИЕ
Слайд 5
КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
При таком виде ингибирования ингибитор по своей
структуре похож на субстрат фермента. Поэтому он соперничает с
субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата.
Слайд 6
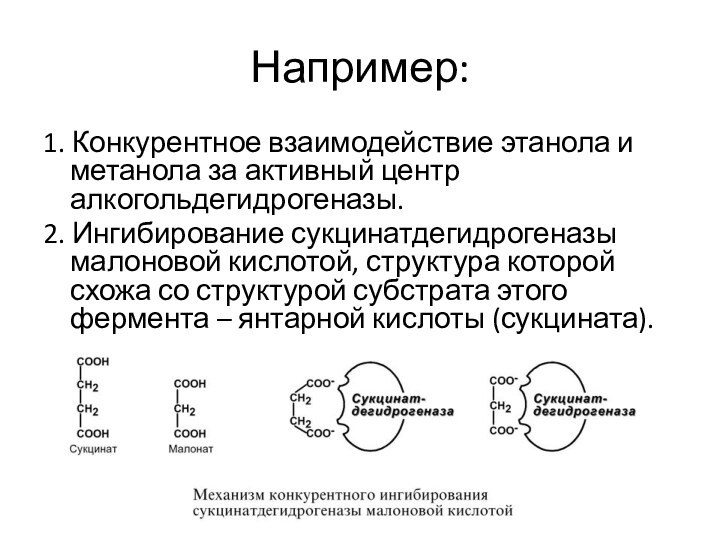
Например:
1. Конкурентное взаимодействие этанола и метанола за активный
центр алкогольдегидрогеназы.
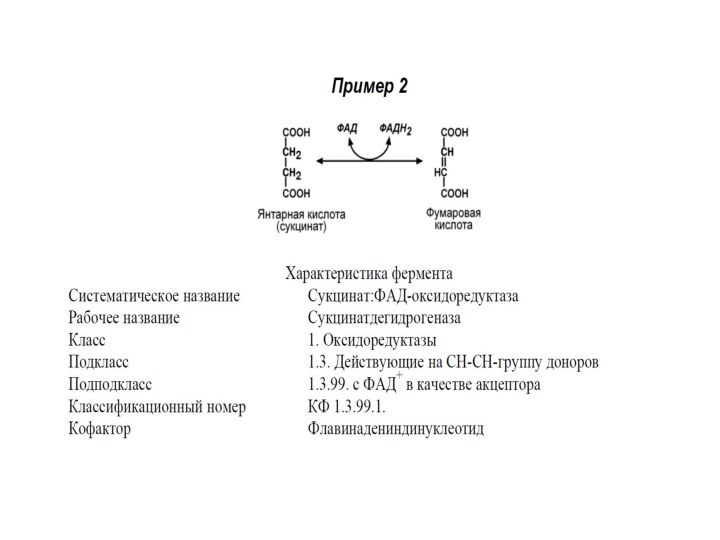
2. Ингибирование сукцинатдегидрогеназы малоновой кислотой, структура которой схожа
со структурой субстрата этого фермента – янтарной кислоты (сукцината).
Слайд 7
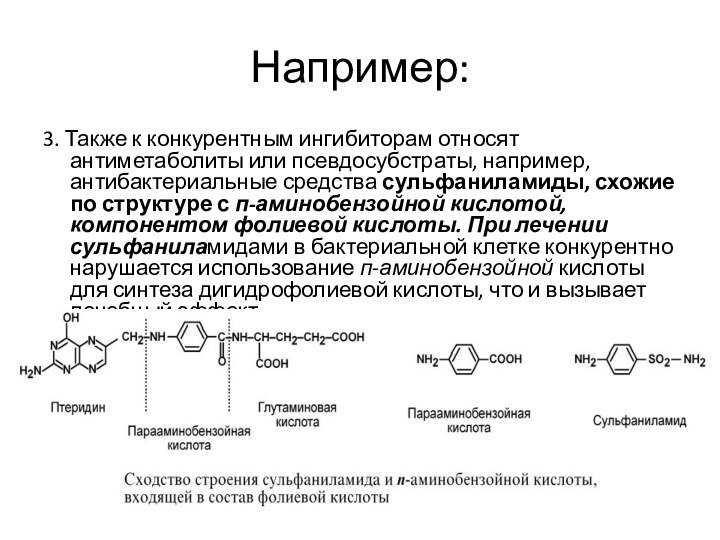
Например:
3. Также к конкурентным ингибиторам относят антиметаболиты или
псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с
п-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п-аминобензойной кислоты для синтеза дигидрофолиевой кислоты, что и вызывает лечебный эффект.
Слайд 8
НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Данный вид ингибирования связан с присоединением ингибитора
не в активном центре, а в другом месте молекулы.
Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо токсинов.
Например, синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
Слайд 9
ЭНЗИМОПАТОЛОГИИ
Энзимопатологии (энзимопатии) – состояния, связанные с патологическим изменением
активности ферментов.
Наиболее часто встречается снижение активности и нарушение
каких-либо метаболических процессов. В результате энзимопатклиническое значение может иметь накопление субстрата реакции (как при фенилкетонурии) или недостаток продукта (при альбинизме) или обе особенности одновременно (гликогенозы). По характеру нарушения выделяют первичные и вторичные энзимопатии.
Слайд 10
Первичные (наследственные) энзимопатии связаны с генетическим дефектом и
наследственным снижением активности. Например, фенилкетонурия связана с дефектом фенилаланин-4-монооксигеназы,
которая превращает фенилаланин в тирозин. В результате накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект.
Заболевание подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты.
Кроме указанных, распространенными первичными энзимопатиями являются галактоземия, недостаточность лактазы и сахаразы, гликогенозы, наследственные гипераммониемии, различные липидозы.
Слайд 11
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов,
вирусных инфекций и т.п., что приводит к нарушению синтеза
фермента или условий его работы.
Например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак.
Другим примером может служить недостаточность ферментов желудочно-кишечного тракта при заболеваниях желудка, поджелудочной железы или желчного пузыря. Недостаток витаминов и их коферментных форм также является причиной приобретенных ферментопатий.
Слайд 12
ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ
И ИХ ИНГИБИТОРОВ В МЕДИЦИНЕ
Использование ферментов в
медицине происходит по трем направлениям:
энзимодиагностика,
энзимотерапия,
использование ферментов
в медицинских технологиях и промышленности.
Также активно нашло применение использование ингибиторов ферментов.
Слайд 13
ЭНЗИМОДИАГНОСТИКА
Энзимодиагностика – это исследование активности ферментов плазмы крови,
мочи, слюны с целью диагностики тех или иных заболеваний.
Примером может служить фермент лактатдегидрогеназа, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры.
Увеличение активности α-амилазы в плазме крови и моче наблюдается при воспалительных процессах в поджелудочной и слюнных железах.
Инфаркт миокарда сопровождается увеличением активности лактатдегидрогеназы, креатинкиназы, аспартатаминотрансферазы.
Слайд 14
ЭНЗИМОТЕРАПИЯ
Энзимотерапия – это использование ферментов в качестве лекарственных

средств.
Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта
(Фестал, Панзинорм форте, Мезим форте, Энзистал и т.п.), используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте.
Тканевой фермент гиалуронидаза используется организмом для обратимого изменения проницаемости межклеточного вещества. Лекарственную форму гиалуронидазы – лидазу – вводят для размягчения рубцов, появления подвижности в суставах, рассасывания гематом.
Цитохром С – фермент, участвующий в процессах тканевого дыхания. Его используют при асфиксии новорожденных, астматических состояниях, сердечной недостаточности, различных видах гепатита и т.п.
Рибонуклеаза и дезоксирибонуклеаза входят в состав глазных капель и используются при вирусных конъюнктивитах. При нанесении на рану они разжижают гной, при ингаляциях уменьшают вязкость слизи, деполимеризуя нуклеиновые кислоты в мокроте.
Трипсин используют при бронхолегочных заболеваниях для разжижения густой и вязкой мокроты.
Фицин используется в фармацевтической промышленности в качестве добавки к зубным пастам для удаления зубного налета.
Коллагеназу применяют для ускорения отторжения некротизированных тканей, для очистки трофических язв.
Слайд 15
ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ
В МЕДИЦИНСКИХ ТЕХНОЛОГИЯХ
А. Специфичность ферментов к определенным

субстратам широко используется в настоящее время в лабораторной диагностике.
многие
лабораторные методы основаны на взаимодействии добавляемого извне фермента с определяемым соединением. В результате возникает специфичный продукт реакции, после определения содержания последнего судят о концентрации искомого вещества (глюкозооксидазный, холестеролоксидазный методы)
иммуноферментные методы, основанные на образовании тройного комплекса фермент-антиген-антитело. Определяемое вещество не является субстратом фермента, но является антигеном. Фермент может присоединять этот антиген вблизи от активного центра. Если в среде есть антиген, то при добавлении антител и формировании тройного комплекса активность фермента изменяется. Активность фермента измеряют любым способом.
Б. В промышленности ферменты используются в различных отраслях:
глюкозооксидаза в сочетании с каталазой применяется для удаления кислорода из сухого молока, кофе, пива, майонезов, лимонных, апельсиновых и виноградных соков, лекарственных препаратов.
Слайд 16
ИСПОЛЬЗОВАНИЕ ИНГИБИТОРОВ ФЕРМЕНТОВ
Весьма широко используются в настоящее время

ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда
происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы.
Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и используются при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции.
Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), используются при снижении выработки нейромедиаторов катехоламинов в ЦНС и для лечения паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе.
Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления.
Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов. Используется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры.
Ингибиторы гидроксиметилглутарил-S-КоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях.
Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни.
Слайд 17
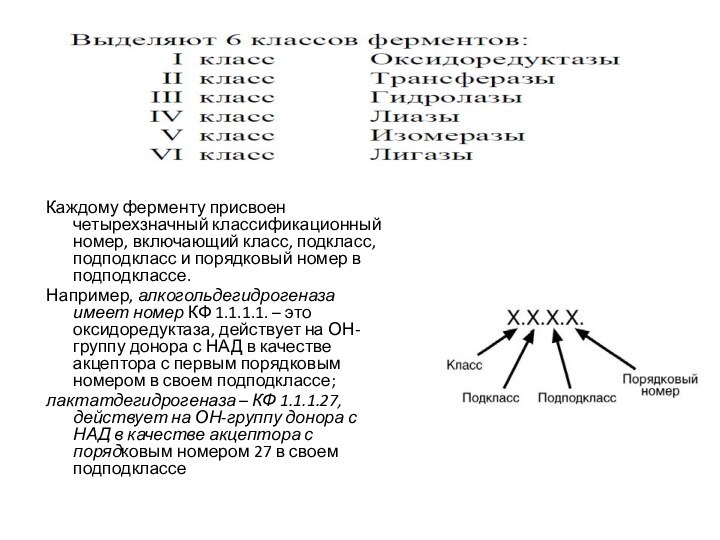
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
В 1961 г в Москве V Международный
биохимический союз принял современную классификацию ферментов.
В соответствии с этой
классификацией все ферменты делятся:
на классы – по типу катализируемой реакции,
каждый класс подразделяется на подклассы – по природе атакуемой химической группы
подклассы делятся на подподклассы – по характеру атакуемой связи или по природе акцептора.
Слайд 18
Каждому ферменту присвоен четырехзначный классификационный номер, включающий класс,
подкласс, подподкласс и порядковый номер в подподклассе.
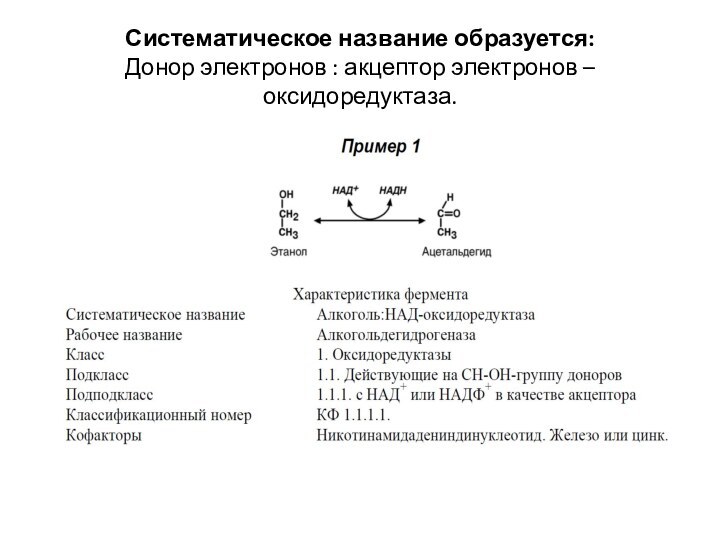
Например, алкогольдегидрогеназа имеет
номер КФ 1.1.1.1. – это оксидоредуктаза, действует на ОН-группу донора с НАД в качестве акцептора с первым порядковым номером в своем подподклассе;
лактатдегидрогеназа – КФ 1.1.1.27, действует на ОН-группу донора с НАД в качестве акцептора с порядковым номером 27 в своем подподклассе
Слайд 19
НОМЕНКЛАТУРА ФЕРМЕНТОВ
Тривиальное название – название, сложившееся исторически.
Например, пепсин, трипсин. Для некоторых ферментов к
названию субстрата добавляется окончание "-аза" – уреаза, амилаза, липаза.
2. Систематическое название – согласно современной классификации.
Как производное систематического названия у многих ферментов имеется одно или несколько рабочих названий.
Слайд 20
I КЛАСС. ОКСИДОРЕДУКТАЗЫ
Ферменты катализируют окислительно-восстановительные реакции, лежащие в
основе биологического окисления. Класс насчитывает 22 подкласса.
Коферментами этого
класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СН-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры
Слайд 21
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы –
оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора
водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Слайд 22
Систематическое название образуется:
Донор электронов : акцептор электронов –
оксидоредуктаза.
Слайд 24
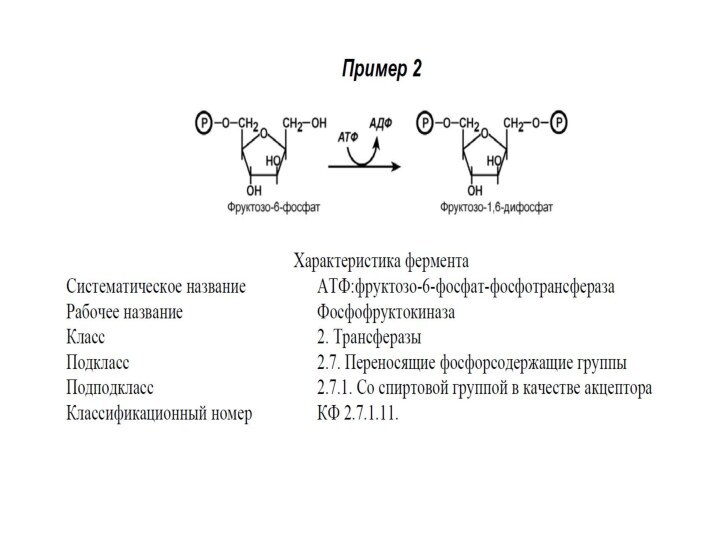
II КЛАСС. ТРАНСФЕРАЗЫ
Катализируют реакции переноса различных групп от
одного субстрата (донор) к другому (акцептор), участвуют в реакциях
взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин.
Класс подразделяется на 9 подклассов в зависимости от строения переносимых ими групп.
Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы.
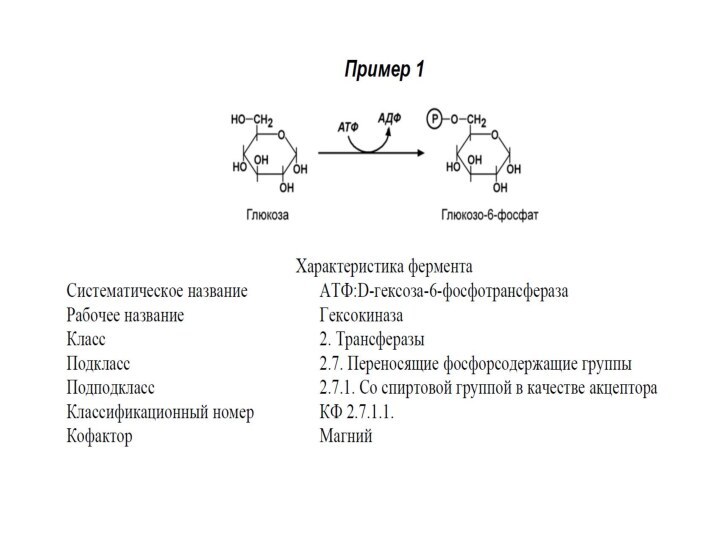
Систематическое название образуется:
Донор группы : акцептор группы – переносимая группа трансфераза.
Слайд 27
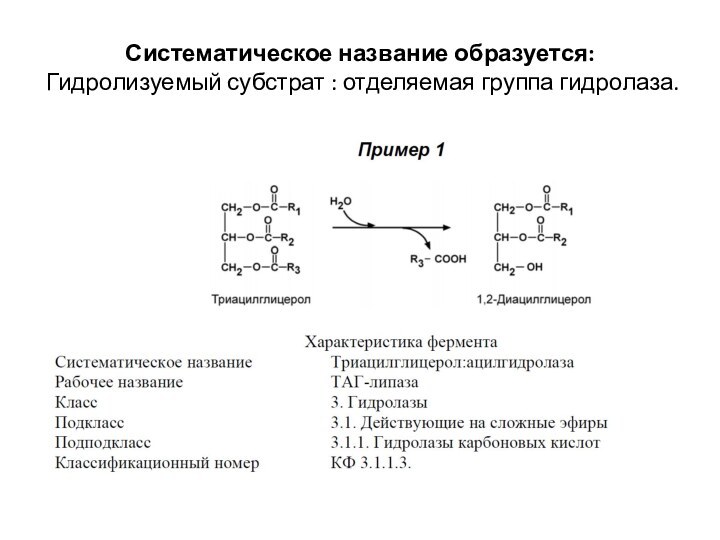
III КЛАСС. ГИДРОЛАЗЫ
Гидролазы – ферменты, осуществляющие разрыв внутримолекулярных
связей в субстрате (за исключением С-С связей) путем присоединения
элементов Н2О, подразделяются на 13 подклассов.
Ввиду сложности многих субстратов у ряда ферментов сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют.
Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи.
Гидролазы представлены ферментами желудочно-кишечного тракта (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры.
Исторически названия гидролаз складывались из названия субстрата с окончанием "-аза" – коллагеназа, амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз:
Слайд 28
1. Эстеразы – гидролиз сложноэфирных связей.
2. Липазы –
гидролиз нейтральных жиров.
3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты.
4.
Гликозидазы – гидролизуют О- и S-гликозидные связи.
5. Протеазы, пептидазы – гидролиз белков и пептидов.
6. Нуклеазы – гидролиз нуклеиновых кислот.
Слайд 29
Систематическое название образуется:
Гидролизуемый субстрат : отделяемая группа гидролаза.
Слайд 31
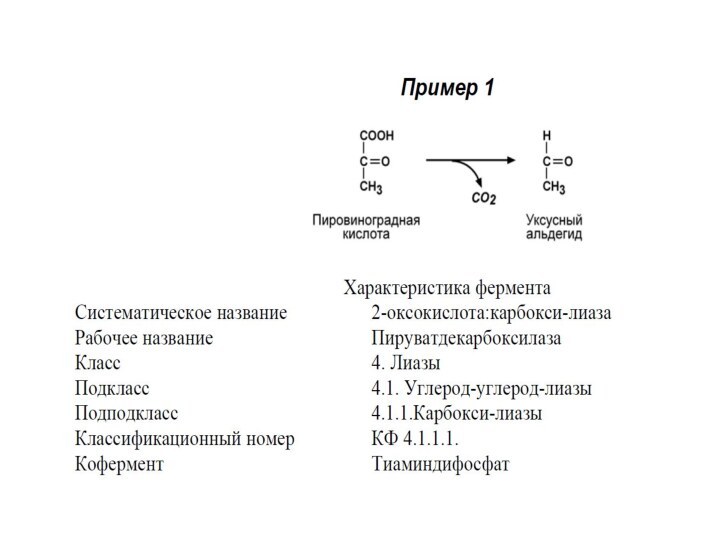
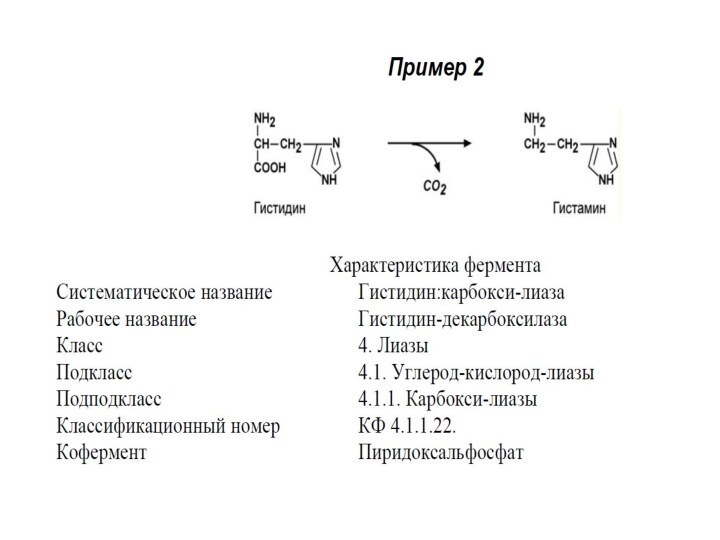
IV КЛАСС. ЛИАЗЫ
Лиазы – ферменты, катализирующие разрыв С-О,
С-С, C-N и других связей, а также обратимые реакции
отщепления различных групп негидролитическим путем.
Выделяют 7 подклассов.
Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи.
Лиазы являются сложными ферментами.
Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.
Примером подклассов являются ферменты, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи.
Систематическое название образуется:
Расщепляемый субстрат : отделяемая группа – лиаза
Слайд 34
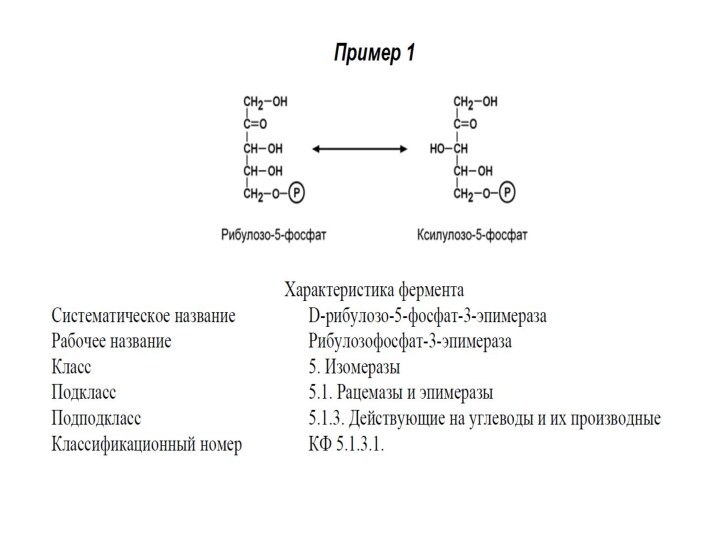
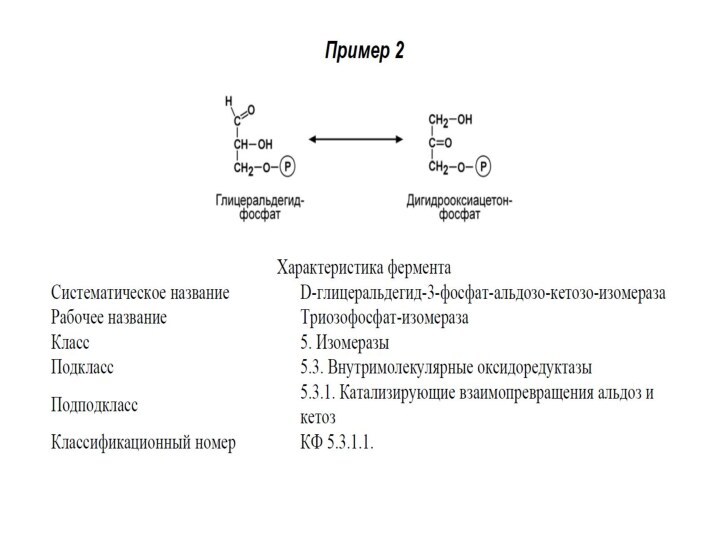
V КЛАСС. ИЗОМЕРАЗЫ
Изомеразы – ферменты, катализирующие изомерные превращения
в пределах одной молекулы. Изомеразы – сложные ферменты. К
их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др.
Выделяют 6 подклассов изомераз в зависимости от типа реакции.
Например, в первый подкласс выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) и эпимеразы (превращения D,L-изомеров, имеющих более одного центра асимметрии, например, α-D-глюкозу в β-D-глюкозу), в другие подклассы – цис-транс-изомеразы, внутримолекулярные трансферазы (мутазы), далее внутримолекулярные оксидоредуктазы.
Систематическое название образуется:
Субстрат – [ ] – реакция, где [ ] – обозначение, отражающее суть реакции, например, "номер изменяемого атома углерода", изменение "цис-транс", изменение "кето-енол", изменение "альдозо-кетозо".
Слайд 37
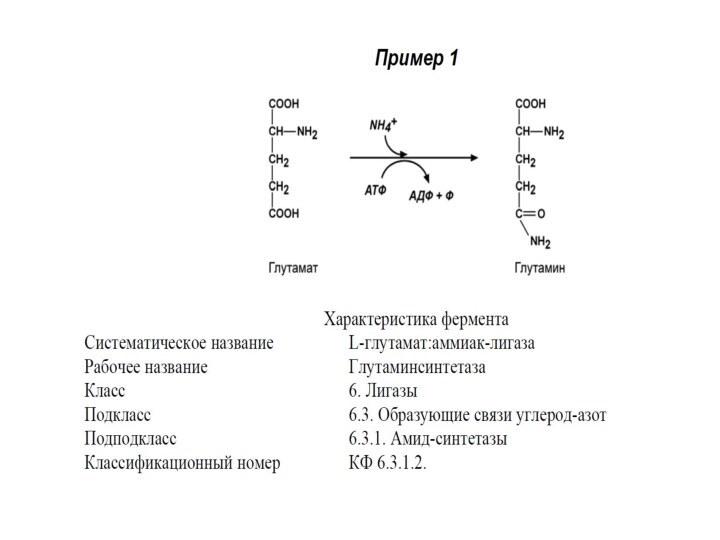
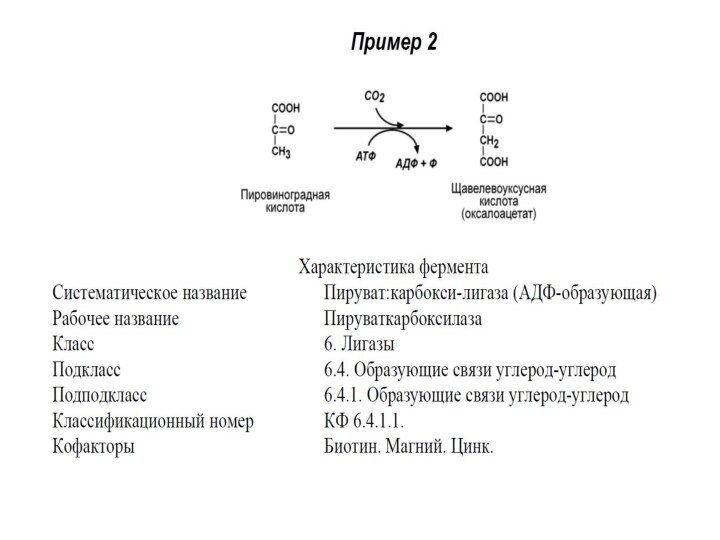
VI КЛАСС. ЛИГАЗЫ
Лигазы (синтетазы) – ферменты, катализирующие присоединение
друг к другу двух молекул с использованием энергии высокоэнергетических
связей АТФ (или других макроэргов).
Лигазы – сложные ферменты. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты.
Выделяют 6 подклассов.
Примером подклассов служат группы ферментов по виду образуемой связи: углерод-кислород, углерод-сера, углерод-азот, углерод-углерод.
Систематическое название образуется:
Субстрат 1 : субстрат 2 – лигаза