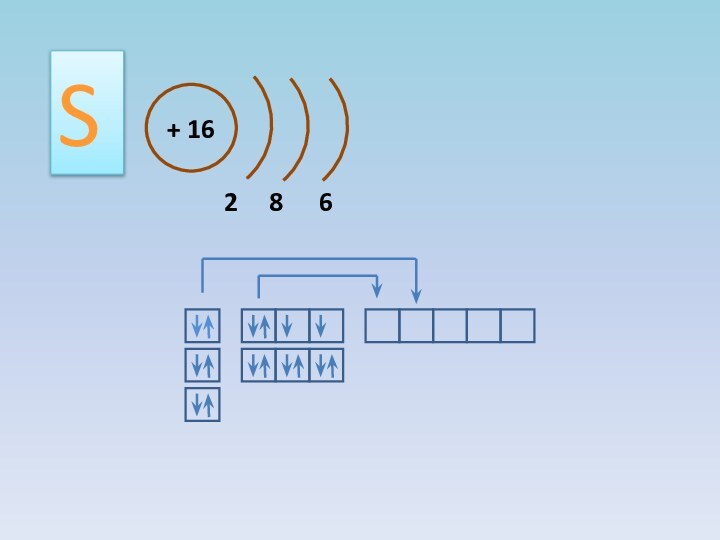
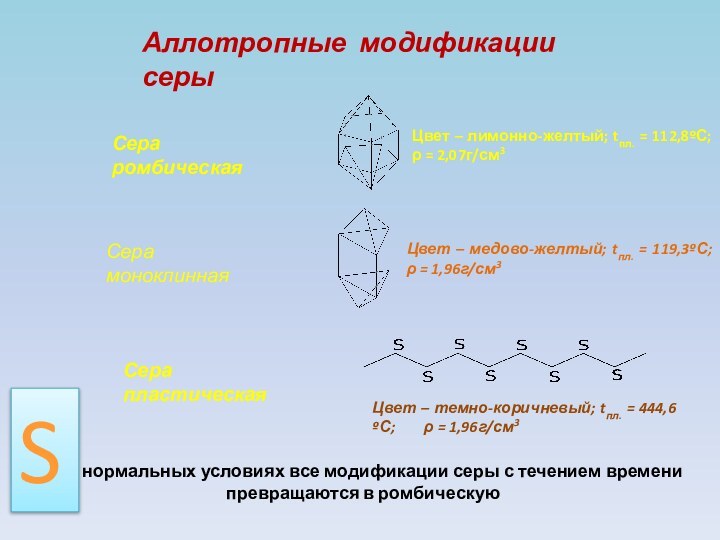
+4, +6;
атом серы может быть и окислителем, и восстановителем:
Восстановитель
Или окислитель,
или восстановитель
Окислитель
-2
H2S
K2S
0
S
+4
SO2
H2SO3
K2SO3
+6
SO3
H2SO4
K2SO4