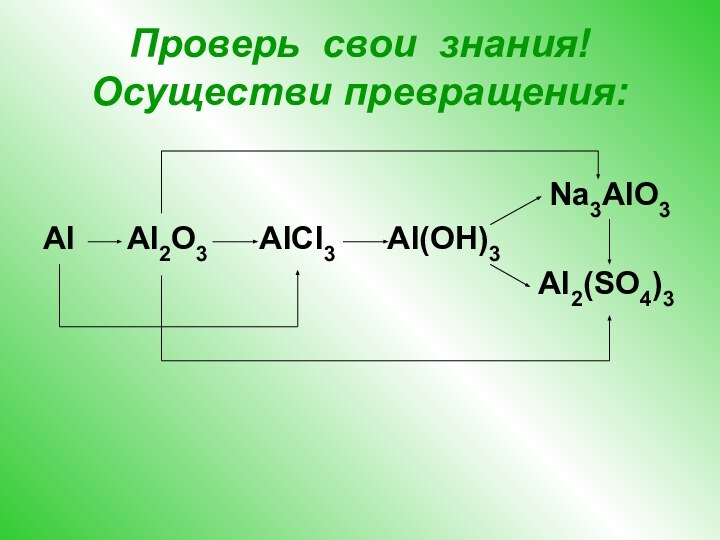
путем изучить амфотерность оксида и гидроксида алюминия,
уметь составлять
уравнения реакций с участием соединений алюминия в свете ТЭД,показать большое практическое значение алюминия и его соединений.
Цели урока: