- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Галогены
Содержание
- 2. Галогены – элементы VIIА – группы. Галогены
- 3. Строение и свойства атомов.F )2 )7Cl )2
- 4. Строение и свойства атомов.Галогены: фтор F, хлор
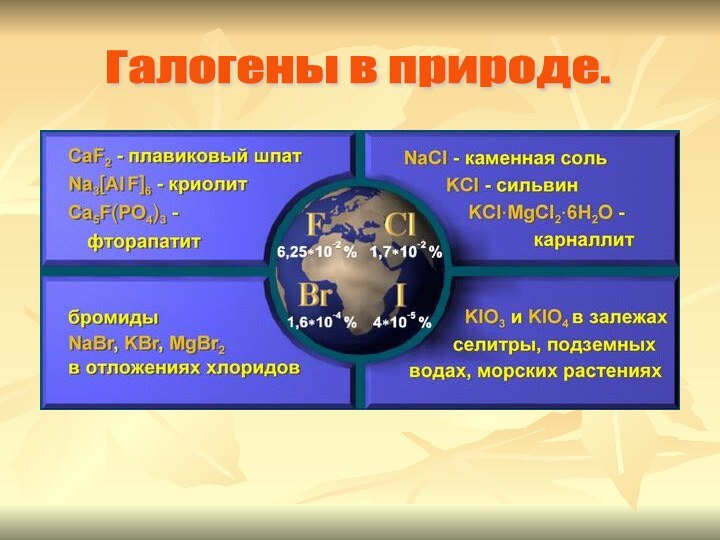
- 5. Галогены в природе.
- 6. Галогены – простые вещества. Все галогены существуют
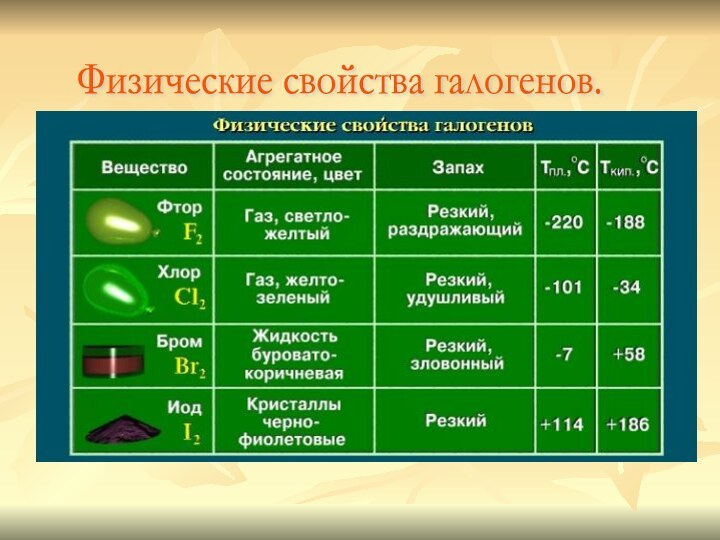
- 7. Физические свойства галогенов.
- 8. Химические свойства галогенов.Взаимодействие с металлами.Zn0 + F20→
- 9. Открытие галогенов.Фтор в свободном виде получил впервые
- 10. Карл Вильгельм Шееле (1742 - 1786)Шведский
- 11. Выводы: При движении по группе сверху вниз:Увеличивается
- 12. Скачать презентацию
- 13. Похожие презентации
Галогены – элементы VIIА – группы. Галогены – типичные неметаллы. Общее название подгруппы «галогены», т.е. «рождающие соли».Галогены.










Слайд 2
Галогены – элементы VIIА – группы. Галогены –
типичные неметаллы. Общее название подгруппы «галогены», т.е. «рождающие соли».
Слайд 3
Строение и свойства атомов.
F )2 )7
Cl )2 )8
)7
Br )2 ) 8)18 )7
I )2 )8 )18 )18
)7At )2 )8 )18 ) 32) 18)7
Общая формула – ns2np5
Слайд 4
Строение и свойства атомов.
Галогены: фтор F, хлор Cl,
бром Br, йод I, астат At (редко встречающийся в
природе) – типичные неметаллы. Их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы этих элементов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли.Галогены – очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
Слайд 6
Галогены – простые вещества.
Все галогены существуют в
свободном состоянии в виде двухатомных молекул с ковалентной неполярной
химической связью между атомами. В твердом состоянии F2, Cl2, Br2, I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами.
Слайд 8
Химические свойства галогенов.
Взаимодействие с металлами.
Zn0 + F20→ Zn+2F2-1
Взаимодействие
с водородом.
H2 + Г2 →2НГ
Взаимодействие с растворами солей.
Cl2 +
2NaBr→ 2NaCl + Br2
Слайд 9
Открытие галогенов.
Фтор в свободном виде получил впервые в
1866 г. Французский химик Анри Муассан, который был удостоен
Нобелевской премии. Свое название элемент получил от греч. фторос – разрушающий. Хлор открыт химиком К. Шееле в 1774 г. Элемент получил название за свой цвет ( от греч. хлорос – желто - зеленый).
Бром открыт в 1826 г. Французским химиком А. Баларом. Элемент назван так за свой запах (греч. бромос – зловонный).
Йод получен в 1811 г. французским ученым Б. Куртуа, а название получил за цвет своих паров (греч. иодэс – фиолетовый).