реторте глиняной простой. Слыву я главной кислотой... Когда сама
я растворяюсь В воде, то сильно нагреваюсь…Серная кислота
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


























Серная кислота
Менделеев Д.И.
4. С какими из перечисленных формул веществ взаимодействует раствор соляной кислоты:
Cu, KOH, CO2, Zn, CuO, AgNO3
Облака планеты Венера
Техника безопасности:
Кислоту приливают в воду осторожно, тоненькой струйкой.
белый
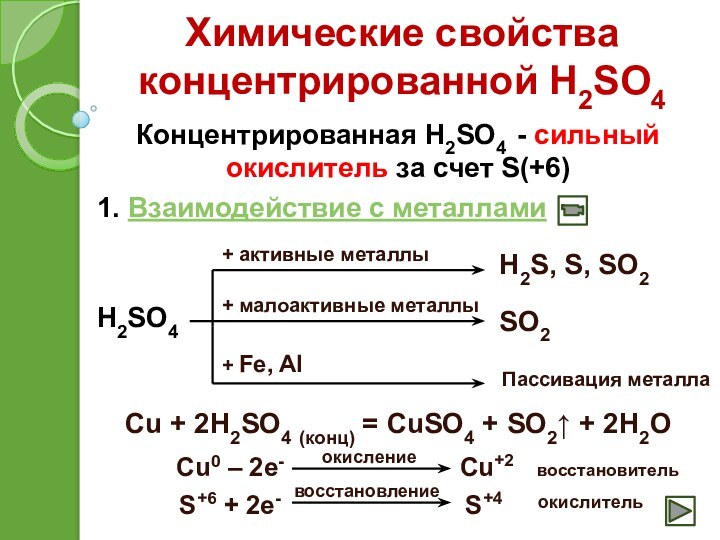
+ Fe, Al
H2S, S, SO2
SO2
Пассивация металла
Cu + 2H2SO4 (конц) = CuSO4 + SO2↑ + 2H2O
Cu0 – 2e-
Cu+2
S+6 + 2e-
S+4
окисление
восстановление
восстановитель
окислитель
4. Взаимодействие с солями
H2SO4(конц) + NaCl(тв) = NaHSO4 + HCl↑