880 –
Мустафаева Диана
учитель химии ГБОУ школы № 880,
город Москва -
Гершановская Евгения Владимировна
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



















H2SO4
Характеристика:
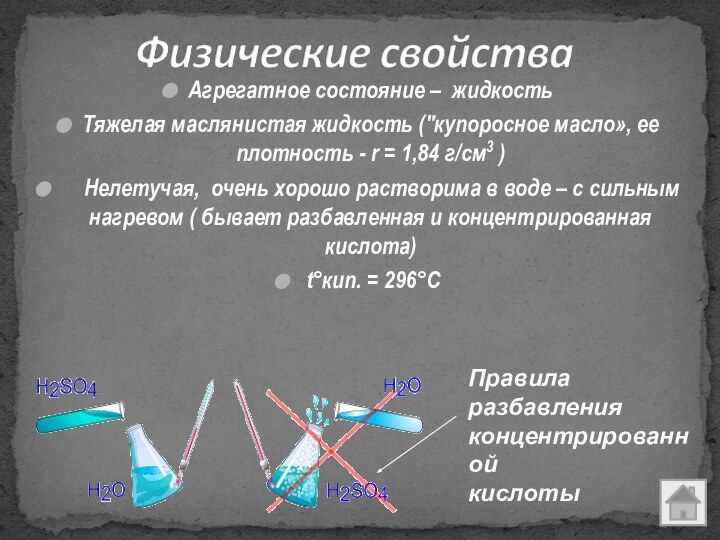
Правила
разбавления
концентрированной
кислоты
Если вдруг захочешь кислоту ты растворить,
Надо правило важное повторить:
Концентрированная серная кислота при нагревании может взаимодействовать с металлами, расположенными в ряду напряжений металлов правее водорода.
При этом продуктом реакции является сернистый газ:
Cu + H2SO4 ----CuSO4 + SO2 + H2O
Zn + H2SO4 ---ZnSO4 + S + H2O
В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.
Сульфаты (SO4) – средние соли
Гидросульфаты (НSO4) – кислые соли
2Н2О)
(CaSO4
Это одно из чудес камчатской природы
ВЫВОД
Не случайно, перспективные планы развития химической промышленности каждой страны предусматривают увеличение производства серной кислоты и числа требующихся для этого многочисленных установок.