- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Серная кислота
Содержание
- 2. Оглавление Определение и свойстваНазваниеОлеумХимические свойстваИсторияСырье для производстваСтадии полученияПроцесс добычи
- 3. Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени
- 4. Серная кислотаВ технике серной кислотой называют её
- 5. Название До XX века часто серную кислоту
- 6. ОлеумРастворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют
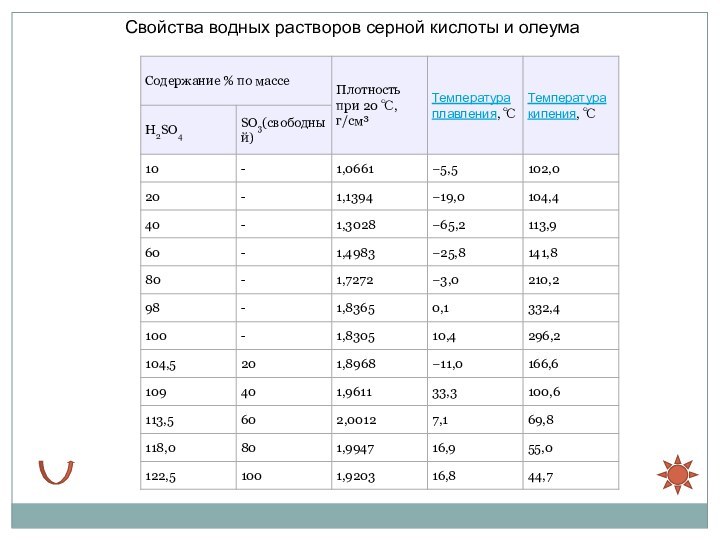
- 7. Свойства водных растворов серной кислоты и олеума
- 8. Химические свойстваСерная кислота — довольно сильный окислитель, особенно при
- 9. Химические свойстваСерная кислота реагирует также с основными
- 10. ИсторияНесмотря на то, что серная кислота давно известна, вначале
- 11. СырьеСырьём для ее получения служат элементарная сера, сульфиды и сульфаты металлов, сероводород,
- 12. Основные стадии получения серной кислоты включают: Сжигание или обжиг сырья в кислороде с получением SO2Очистка от примесей газаОкисление SО2 в SO3Абсорбция SO3 водой.
- 13. Процесс добычиC XIV века серную кислоту получали
- 14. Скачать презентацию
- 15. Похожие презентации
Оглавление Определение и свойстваНазваниеОлеумХимические свойстваИсторияСырье для производстваСтадии полученияПроцесс добычи











Слайд 2
Оглавление
Определение и свойства
Название
Олеум
Химические свойства
История
Сырье для производства
Стадии получения
Процесс
добычи
Слайд 3
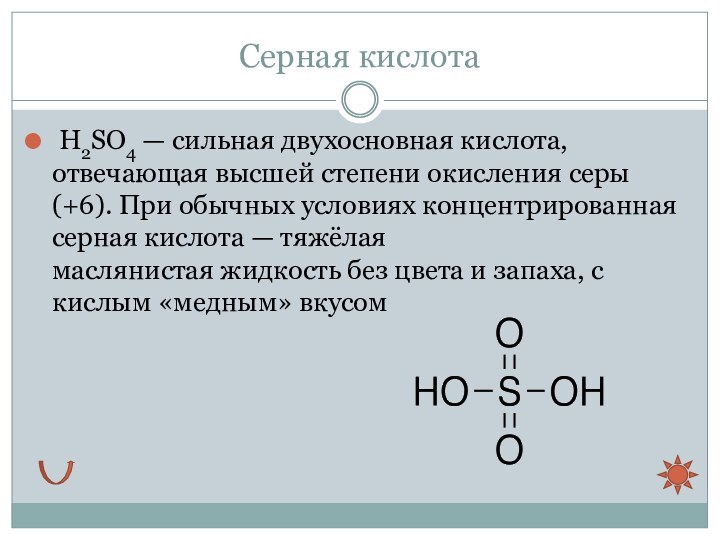
Серная кислота
H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления
серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая
маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом
Слайд 4
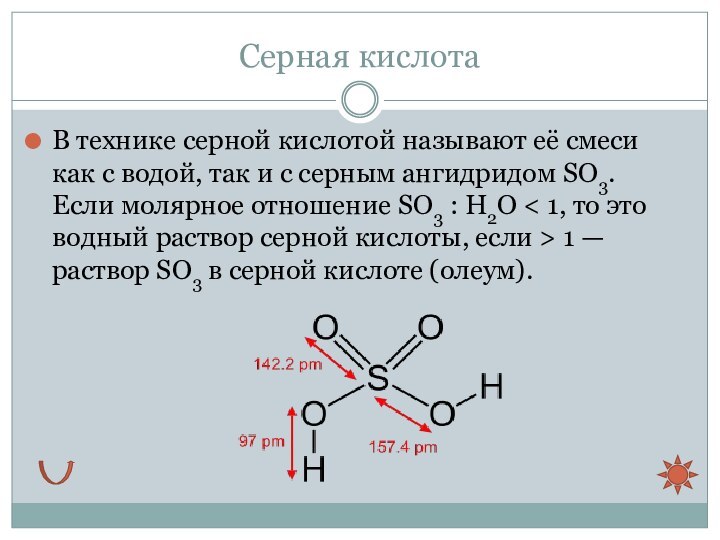
Серная кислота
В технике серной кислотой называют её смеси
как с водой, так и с серным ангидридом SO3. Если молярное
отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).
Слайд 5
Название
До XX века часто серную кислоту называли
купоросом (как правило это был кристаллогидрат, по консистенции напоминающий
масло) или купоросным маслом, очевидно отсюда происхождение названия ее солей (а точнее именно кристаллогидратов) — купоросы.
Слайд 6
Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два
соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Температура
кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
Слайд 8
Химические свойства
Серная кислота — довольно сильный окислитель, особенно при нагревании
и в концентрированном виде; окисляет HI и частично HBr
до свободных галогенов, углерод до CO2, серу — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и H2S. Концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые —гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Слайд 9
Химические свойства
Серная кислота реагирует также с основными оксидами,
образуя сульфат и воду.
На металлообрабатывающих заводах раствор
серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты.
Слайд 10
История
Несмотря на то, что серная кислота давно известна, вначале ее
получали сухой перегонкой, поэтому упоминается под названием "купоросное масло",
в промышленных количествах она стала производиться относительно недавно.
Слайд 11
Сырье
Сырьём для ее получения служат элементарная сера, сульфиды и сульфаты металлов, сероводород, отходящие
газы теплоэлектростанций, использующих неочищенную нефть, и др. Основным сырьём
является пирит.
Слайд 12
Основные стадии получения серной кислоты включают:
Сжигание или обжиг
сырья в кислороде с получением SO2
Очистка от примесей газа
Окисление SО2 в SO3
Абсорбция SO3 водой.
Слайд 13
Процесс добычи
C XIV века серную кислоту получали "камерным"
методом, в основе которой лежала реакция горения на воздухе смеси
серы и калийной селитры, описанная алхимиком Валентином. Процесс проводился в камерах, обитых свинцом, нерастворимым в серной кислоте. Продуктами горения являлись оксиды азота, соли калия и SO3. Последний поглощался водой, находящейся в камере. Таким способом удавалось получить кислоту небольшой крепости, которую концентрировали известными методами.