- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сероводород
Содержание
- 2. Подготовили: ученики 9 класса АГимназии №1 Зорин
- 3. Сероводоро́д, сернистый водород (H2S) — бесцветный газ
- 4. Нахождение в природеВстречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках.
- 5. СвойстваТермически неустойчив (при температурах больше 400 °C
- 6. ПолучениеВ лаборатории обычно получают действием разбавленных кислот
- 7. ПрименениеСероводород из-за своей токсичности находит ограниченное применение.В
- 8. Скачать презентацию
- 9. Похожие презентации
Подготовили: ученики 9 класса АГимназии №1 Зорин СергейШакенов СерикЮгай ДмитрийОгай Артём С Е Р О В О Д О Р ОД


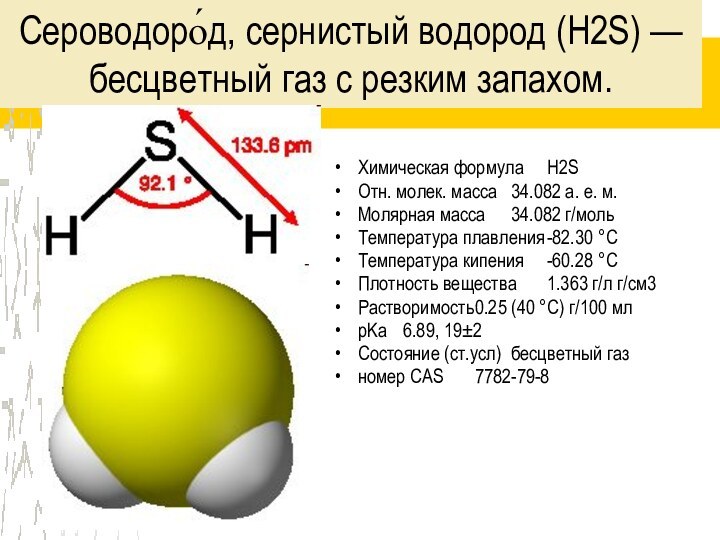




Слайд 3 Сероводоро́д, сернистый водород (H2S) — бесцветный газ с
резким запахом.
Химическая формула H2S
Отн. молек. масса 34.082 а. е. м.
Молярная масса 34.082
г/мольТемпература плавления -82.30 °C
Температура кипения -60.28 °C
Плотность вещества 1.363 г/л г/см3
Растворимость 0.25 (40 °C) г/100 мл
pKa 6.89, 19±2
Состояние (ст.усл) бесцветный газ
номер CAS 7782-79-8
Слайд 4
Нахождение в природе
Встречается в природе в составе нефти,
природного газа, вулканического газа и в горячих источниках.
Слайд 5
Свойства
Термически неустойчив (при температурах больше 400 °C разлагается
на простые вещества — S и H2), ядовитый газ
тяжелее воздуха с неприятным запахом тухлых яиц. Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10-29 Кл·м). В отличие от молекул воды, молекулы сероводорода не образуют прочных водородных связей, поэтому H2S — газ. Насыщенный водный раствор H2S является сероводородной кислотой.
Слайд 6
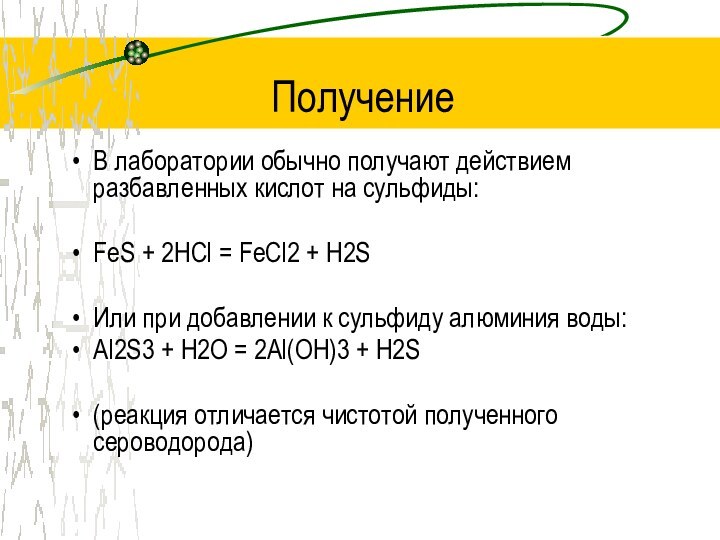
Получение
В лаборатории обычно получают действием разбавленных кислот на
сульфиды:
FeS + 2HCl = FeCl2 + H2S
Или при добавлении
к сульфиду алюминия воды:Al2S3 + H2O = 2Al(OH)3 + H2S
(реакция отличается чистотой полученного сероводорода)
Слайд 7
Применение
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической
химии сероводород и сероводородная вода используются как реагент для
осаждения тяжёлых металлов, сульфиды которых очень слабо растворимыВ медицине — в составе сероводородных ванн
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов
Используют в органическом синтезе для получения тиофена и меркаптанов
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического и химического сырья.