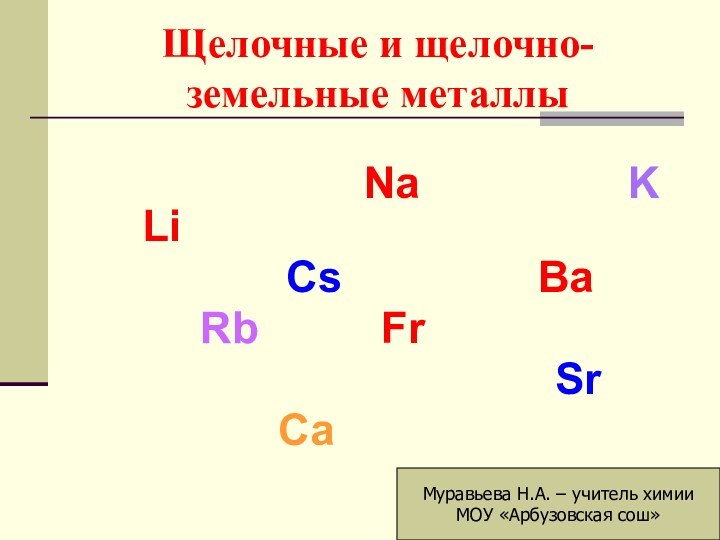
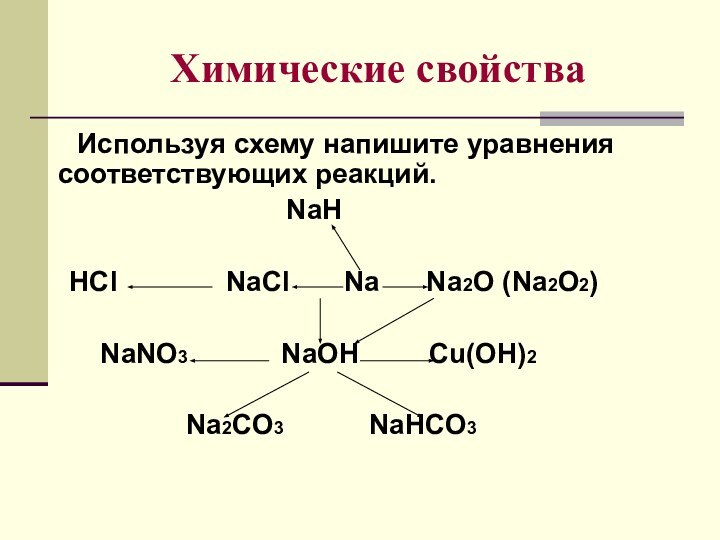
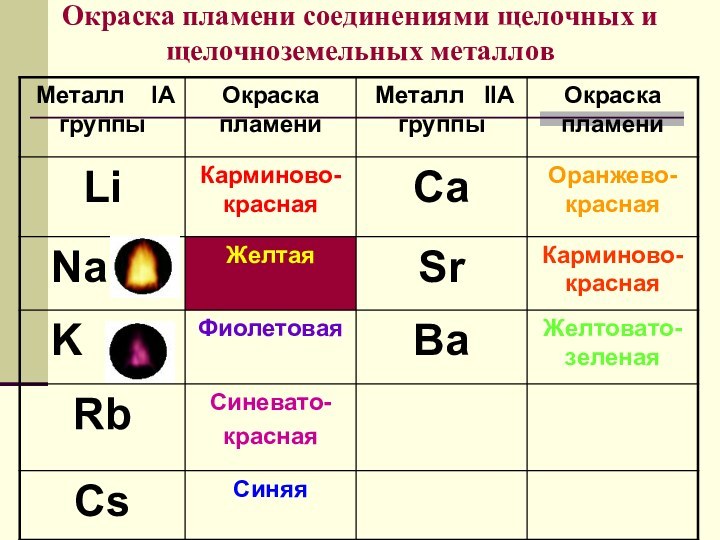
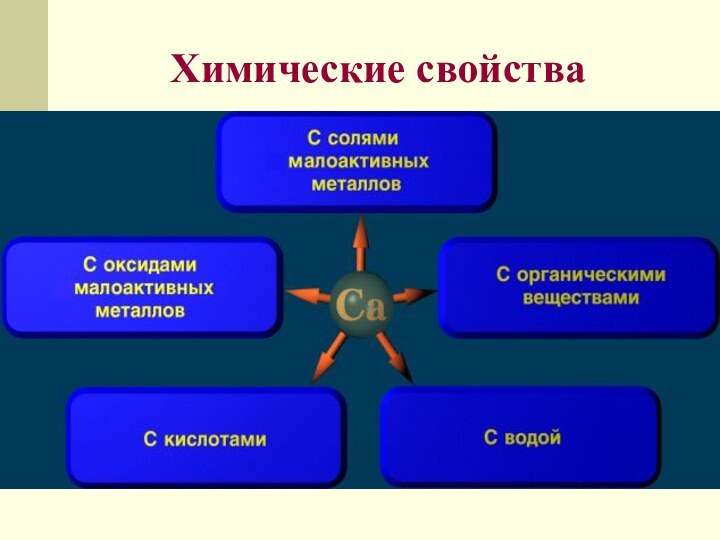
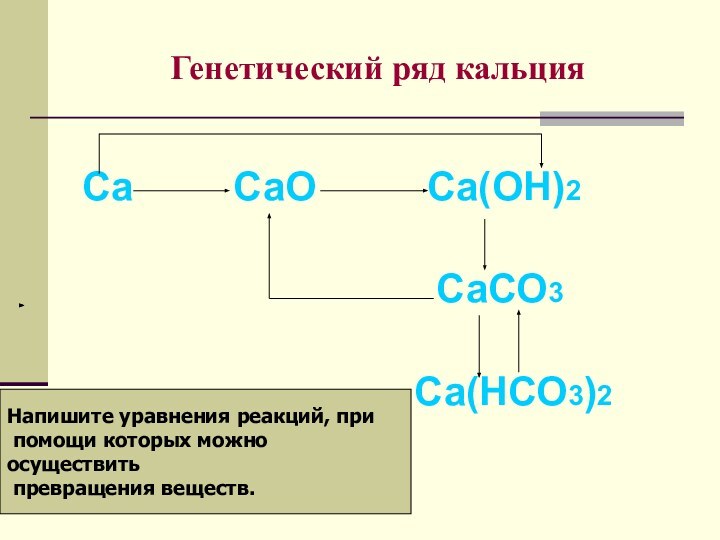
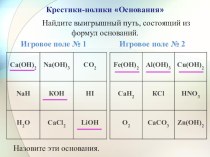
щелочные металлы.
Сколько электронов на внешнем энергетическом уровне у атомов
всех щелочных металлов?Восстановителями или окислителями являются щелочные металлы.
Что имеют в виду говоря о металлических свойствах элемента?