- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Схемы окислительно-восстановительных реакций
Содержание
- 3. Что мы узнаем сегодня на уроке.Какие реакции называются окислительно-восстановительными реакциями.
- 4. Чему научимся.Уравнивать записи окислительно-восстановительных реакций методом электронного баланса
- 5. Что такое степень окисления?
- 6. Осуществите превращения.
- 7. 4P0 + 5O2 0 =2 P2
- 8. Как теперь сформулировать определение окисления
- 9. +3 -2
- 10. +3 -2
- 11. Окислительно-восстановительными называют реакции, протекающие
- 12. Определите, окисляется или восстанавливается сера
- 13. Алгоритм распознавания процессов окисления и восстановления по
- 14. Вывод. Окислительно - восстановительные реакции –
- 15. Основное требование при составлении уравнений
- 16. Разбираем схемы превращений, в
- 17. 1.Составьте молекулярное уравнение. Рассмотрите с точки зрения
- 18. обобщении изученного : 1.Единство, неразрывность окислительно-восстановительного
- 19. Домашнее задание.§43 упражнение№5,7,8Выполнение заданий сопровождается написанием и анализом
- 20. Скачать презентацию
- 21. Похожие презентации


















Слайд 3
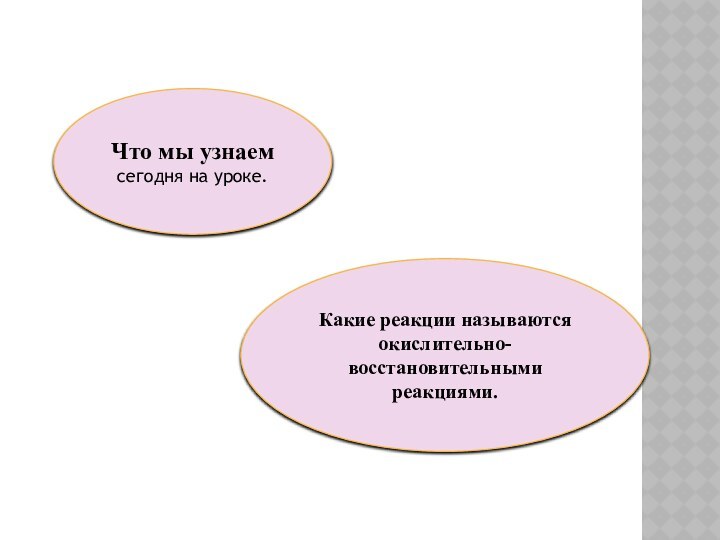
Что мы узнаем сегодня на уроке.
Какие реакции называются
окислительно-восстановительными реакциями.
Слайд 4
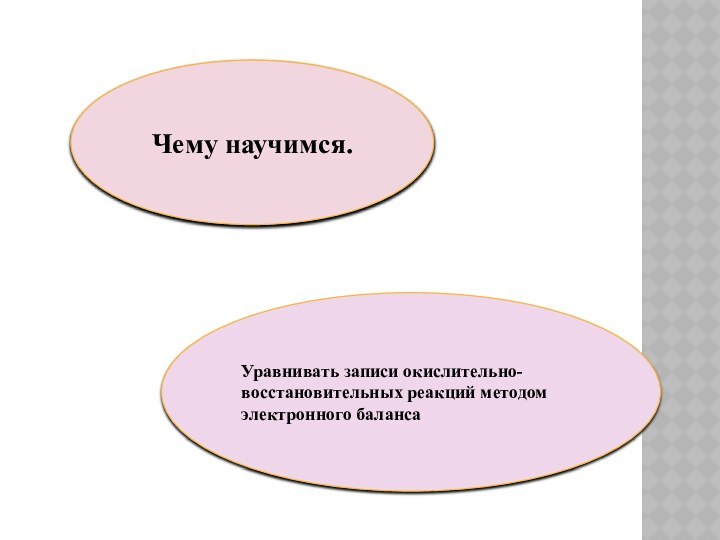
Чему научимся.
Уравнивать записи окислительно-восстановительных реакций методом электронного баланса
Слайд 5
Что такое степень окисления?
Определите степень окисления элементов
по формулам в соединении:
CI2; SO2; CrO3; HNO2; H2SO4.
Слайд 7 4P0 + 5O2 0 =2 P2 +5O5
-2
P2 +5O5 -2 + 3H2 +1O-2 =2
H3 +1P +5O4 -2 Вывод. Реакции, в которых изменяются степени окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Слайд 8 Как теперь сформулировать определение окисления и
восстановления? Уточите содержание и определение этих понятий с позиций
главного признака ОВР.
1.В чем особенность окисления и восстановления элементов при образовании ионной связи?
Раскройте эти процессы, опираясь на схему механизма образования хлорида натрия.
Слайд 9 +3 -2
0 0
+3 -2Fe2O3 + 2Al = 2Fe + Al2 O3
Al0 - 3ē окисление Al+3 процесс окисления
восстановитель
Что такое окисление ?
(Окисление – это процесс отдачи электронов, степень окисления при этом повышается.)
Что такое восстановитель?
( Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.)
Слайд 10 +3 -2
0 0
+3 -2Fe2O3 + 2Al = 2Fe + Al2 O3
Fe+3 + 3ē восстановление Fe0 процесс восстановления
Окислитель
Что такое восстановление?
(Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.)
Что такое окислитель?
( Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.)
Слайд 11 Окислительно-восстановительными называют реакции, протекающие с
изменением степеней окисления атомов реагирующих веществ, в результате перемещении
электронов.
Слайд 12
Определите, окисляется или восстанавливается
сера при
переходах:
a) H2S →SO2 →SO3
б)
SO2 →H2SO3→K2SO3 Какой вывод можно сделать после выполнения генетической цепочки?
Используйте алгоритм распознавания процессов окисления и восстановления по уравнениям реакции.
Слайд 13 Алгоритм распознавания процессов окисления и восстановления по уравнениям
реакции?
1.Определение степеней окисления элементов в обоих частях уравнения.
2.Сравнение степеней
окисления каждого из элементов до и после реакции.3.Вывод об изменение степеней окисления (понижение – признак восстановления, повышение – признак окисления).
Слайд 14
Вывод.
Окислительно - восстановительные реакции – это
такие реакции, при которых происходит переход электронов от одних
атомов, молекул или ионов к другим. Окисление всегда сопровождается восстановлением, восстановление связано с окислением. Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.Слайд 15 Основное требование при составлении уравнений этим
методом: число отданных электронов должно быть равно числу принятых
электронов. 2Zn 0 + O2 0= 2Zn +2O -2
Zn0 ─ 2ē = Zn+2 4 2 восстановитель окисляется
O2 0 + 4 ē = 2O-2 2 1 окислитель восстанавливается
Окисление всегда сопровождается восстановлением, а восстановление окислением. Не бывает одного процесса без другого.
При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции.
Слайд 16 Разбираем схемы превращений, в которых
углерод является окислителем.
А) С0 → С+2
Б) С+2 →
С-2
В) С+4 → С-4
Г) С-4 → С0Используя алгоритм распознавания процессов окисления и восстановления по уравнениям реакции?
Слайд 17 1.Составьте молекулярное уравнение. Рассмотрите с точки зрения окислительно-восстановительных
процессов.
Li + N2 =
Li
+ O2= NaBr + CI2 =
2. К окислительно -восстановительным относится реакция:
2Са + O2 = 2СаO
CaO+H2O = Ca(OH)2
3.Определить окислительно восстановительные реакции. К окислительно -восстановительным относится реакция:
А) CaO+H2O = Ca(OH)2
Б) 2Zn + O2 = 2ZnO
В) Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Г) CaCO3 = CaO + CO2
Самостоятельная работа
Слайд 18
обобщении изученного :
1.Единство, неразрывность окислительно-восстановительного процесса.
2.Схранение числа
электронов в системе (на этой закономерности основана операция расстановки
коэффициентов методом «электронного баланса»).3.Протекание ОВР в сторону образования слабых окислителей и восстановителей из более сильных. (например, взаимное вытеснение галогенами друг друга из соединений).