- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Смещение химического равновесия
Содержание
- 2. Цель урока формирование на межпредметном уровне представлений
- 3. Задачи урокаОбразовательные: ознакомить
- 4. Задачи урокаРазвивающие:
- 5. Задачи урокаВоспитательные: воспитывать экологическую культуру: показать
- 6. Какие из химических реакций являются обратимыми?1. NaOH
- 7. По направленности процесса
- 8. НЕОБРАТИМЫЕ РЕАКЦИИ – ЭТО РЕАКЦИИ, ПРОТЕКАЮЩИЕ В
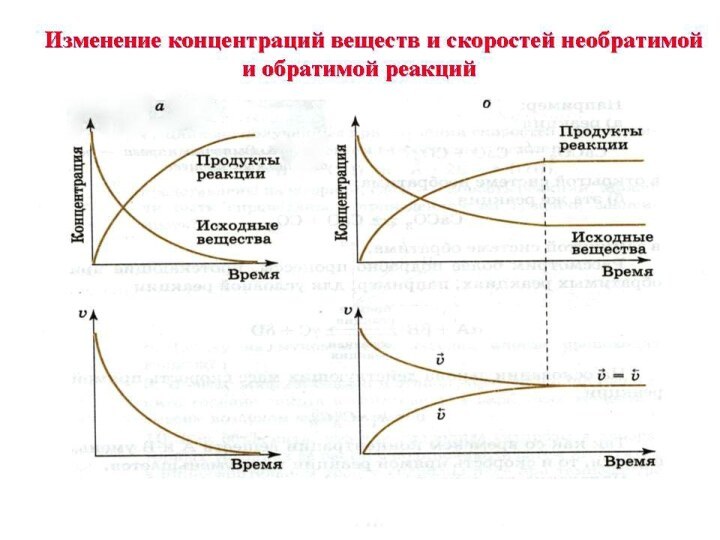
- 9. Обратимые реакции – это реакции,протекающие в данных
- 10. Равновеснные концентрации равновесие является динамическим, т.к. сколько
- 11. Обратимые реакции Н2+ I2 ⬄ 2НI
- 12. Кинетические уравненияСогласно закону действующих масс кинетические уравнения
- 14. Костанта равновесияДля реакции аА + вВ
- 15. N 2 + 3 H2 2 NH3прямаяобратнаяСостояние
- 16. СОСТОЯНИЕ РАВНОВЕСИЯ В ПРИРОДЕКруговорот элементов и веществ
- 17. ПРИНЦИП ЛЕ ШАТЕЛЬЕЕсли на систему, находящуюся в
- 18. Анри Луи Ле Шателье(8. 10. 1850 –
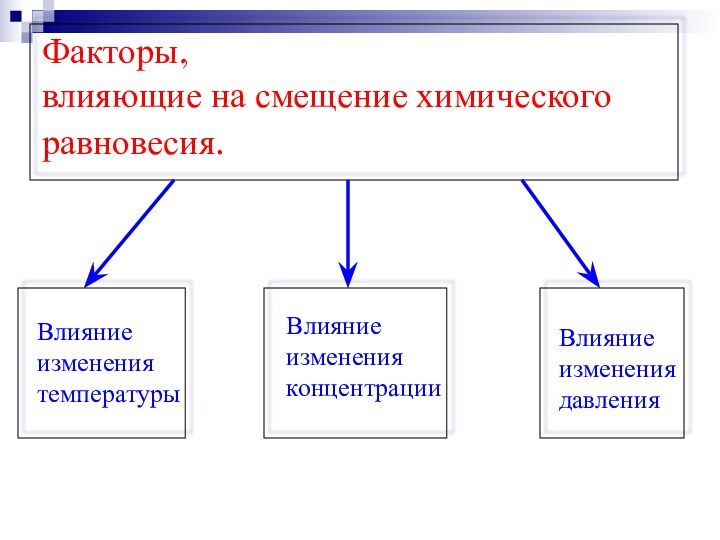
- 19. Факторы, влияющие на смещение химического равновесия.
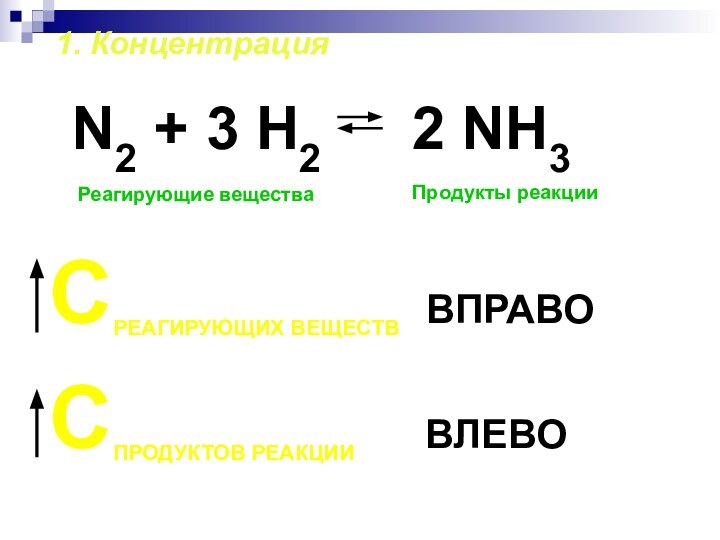
- 20. 1. КонцентрацияN2 + 3 H2Реагирующие веществаПродукты реакцииСРЕАГИРУЮЩИХ
- 21. 2. Температураэндотермическая реакция ( - ( -
- 22. 3. ДавлениеДавление применяется только для газов!N2(г) +
- 23. В какую сторону сместится равновесие в обратимом
- 24. Влияние изменения давления CO2+H2O H2CO3
- 25. Влияние изменения концентрации+ 2-3 капли FeCl3+ 1-2
- 26. ??Влияние изменения температуры 2 пробирки крахмального клейстера
- 27. Как известно, в воздухе содержится
- 28. Принцип Ле Шателье широко используется в химической
- 29. ТестыI Репродуктивный уровень: тесты с альтернативными ответами,
- 30. Тесты с множественным выбором правильного ответа, при
- 31. тесты* Тесты с выбором одного правильного ответа6.
- 32. ТестыТесты с множественным выбором правильного ответа, при
- 33. тесты16. Укажите верное суждение : А) в
- 34. Скачать презентацию
- 35. Похожие презентации



























Слайд 3
Задачи урока
Образовательные:
ознакомить учащихся
с понятиями: обратимые реакции ,равновесие,
равновесные концентрации, константа равновесия. Изучить факторы, влияющие на смещение равновесия.
Слайд 4
Задачи урока
Развивающие:
совершенствовать интеллектуальные умения: выделять главное в рассказе
учителя, развивать умения наблюдать, сравнивать, делать выводы из приведённых наблюдений, совершенствовать умение высказывать и обосновывать суждения, развивать навыки работы с химическими реактивами.
Слайд 5
Задачи урока
Воспитательные:
воспитывать экологическую культуру: показать роль
смещения равновесия в увеличении выхода продукта реакции в химической
промышленности и как следствие уменьшение загрязнения окружающей среды.Воспитывать культуру речи и общения, трудолюбие, самостоятельность в выборе решения проблем.
Слайд 6
Какие из химических реакций являются обратимыми?
1. NaOH +
HCl ? NaCl + H2O
2. N2 + 3H2 ?
2NH33. AgNO3 + NaCl ? AgCl↓ + NaNO3
4. SO3 + H2O ? H2SO4
5. CH4 + 2O2 ? CO2 + 2H2O
6. 2SO2 + O2 ? 2SO3
7. HCOOH + CH3OH ? HCOOCH3 + H2O
Слайд 8
НЕОБРАТИМЫЕ РЕАКЦИИ –
ЭТО РЕАКЦИИ, ПРОТЕКАЮЩИЕ
В ДАННЫХ
УСЛОВИЯХ ТОЛЬКО В ОДНОМ
НАПРАВЛЕНИИ.
К ним можно отнести все
реакции обмена, сопровождающиеся образованием осадка,
газа или
малодиссоциирующего вещества (воды)
и все реакции горения
Слайд 9
Обратимые реакции – это реакции,
протекающие в данных условиях
одновременно в
двух противоположных направлениях
Таких реакций подавляющее большинство.
В
органической химии признак обратимости отражают названия – антонимы процессов
*Гидрирование – дегидрирование
*Гидратация – дегидратация
*Полимеризация – деполимеризация
Обратимы все реакции этерификации
(противоположный процесс носит название
гидролиза)и гидролиза белков, сложных эфиров,
углеводов, полинуклеотидов. Обратимость этих
процессов лежит в основе важнейшего свойства
живого организма – обмена веществ.
Слайд 10
Равновеснные концентрации
равновесие является динамическим, т.к. сколько молекул
продукта прямой реакции образуется в единицу времени, столько их
разлагается в единицу времени при протекании обратной реакции. При этих условиях концентрации всех реагирующих веществ остаются постоянными. Эти концентрации называются равновесными и обозначают их: [ Н2 ], [I2 ], [ НI ].
Слайд 12
Кинетические уравнения
Согласно закону действующих масс кинетические уравнения имеют
вид:
Vпр= k 1 с (Н2) с (I2
) Vоб = k 2 с 2 (НI)
Слайд 14
Костанта равновесия
Для реакции аА + вВ ⬄
сС + дД
[c ]c .[д ] дК равн=-----------------------
[А ]а .[В ] в
Слайд 15
N 2 + 3 H2
2 NH3
прямая
обратная
Состояние системы,
при котором скорость прямой реакции
РАВНА скорости обратной реакции
называется
химическим равновесием
график
Слайд 16
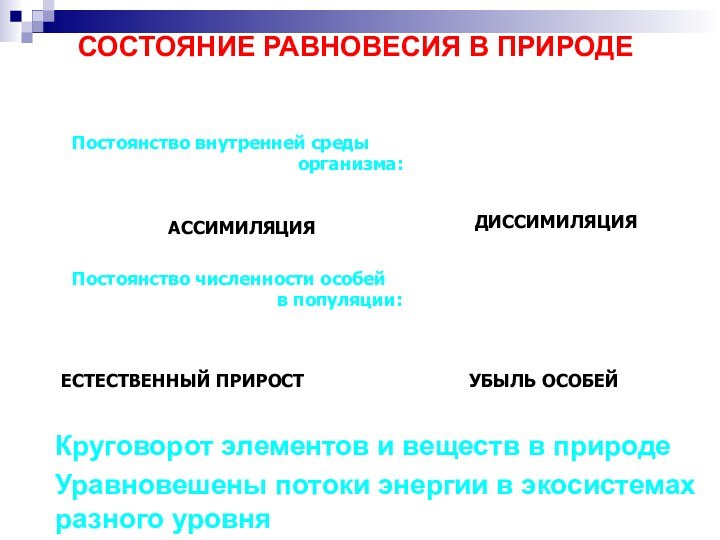
СОСТОЯНИЕ РАВНОВЕСИЯ В ПРИРОДЕ
Круговорот элементов и веществ в
природе
Уравновешены потоки энергии в экосистемах
разного уровня
УБЫЛЬ ОСОБЕЙ
ЕСТЕСТВЕННЫЙ
ПРИРОСТПостоянство численности особей
в популяции:
ДИССИМИЛЯЦИЯ
АССИМИЛЯЦИЯ
Постоянство внутренней среды
организма:
Слайд 17
ПРИНЦИП ЛЕ ШАТЕЛЬЕ
Если на систему,
находящуюся в состоянии
равновесия
произвести внешнее воздействие
(изменить давление, температуру, концентрацию),
то равновесие
сместится в сторону уменьшения данного воздействия
(1884 год)
Слайд 18
Анри Луи Ле Шателье
(8. 10. 1850 – 17.
09. 1936)
Французский физикохимик и металловед,
член Парижской академии наук (с 1907). Родился в Париже.
Учился в Политехнической школе и Высшей горной
школе в Париже. Затем был горным инженером
в Алжире и Безансоне. В 1878 – 1919 профессор
Высшей горной школы. В 1907 – 1925 работал в Парижском
университете.
Исследования относятся к физической химии.
Предложил оригинальный способ определения теплоемкостей
газов при высоких температурах. Сформулировал (1884)
общий закон смещения химического равновесия
(принцип Ле Шателье).
Изучал химические процессы в металлургии. Изучал свойства
и способы приготовления цементов. Создал металлографический
микроскоп и усовершенствовал методику исследования строения
металлов и сплавов. Нашел условия синтеза аммиака.
Президент Французского химического общества (1931).
Иностранный член – корреспондент Петербургской
академии наук (с 1913) и почетный член АН СССР (с 1926).
Слайд 20
1. Концентрация
N2 + 3 H2
Реагирующие вещества
Продукты реакции
СРЕАГИРУЮЩИХ ВЕЩЕСТВ
ВПРАВО
СПРОДУКТОВ РЕАКЦИИ
ВЛЕВО 2 NH3
Слайд 21
2. Температура
эндотермическая реакция ( - ( - Q
)
экзотермическая реакция ( + ( + Q( + Q
)N2 + 3 H2
+Q
- Q
t0c равновесие сместится влево
t0c равновесие сместится вправо
2 NH3 + Q
t0c = - Q
t0c= + Q
Слайд 22
3. Давление
Давление применяется только для газов!
N2(г) + 3
H2(г)
1V
3V
2V
4V
Р равновесие сместится вправо
Р равновесие сместится влево
2NH3(г)
P - V
P
- V Объем твердых и жидких веществ равен нулю
Слайд 23
В какую сторону сместится равновесие
в обратимом процессе,
уравнение которого
2 NO(г) + O2(г) ⬄ 2 NO2(г) + Q , есливправо
влево
вправо
Слайд 24
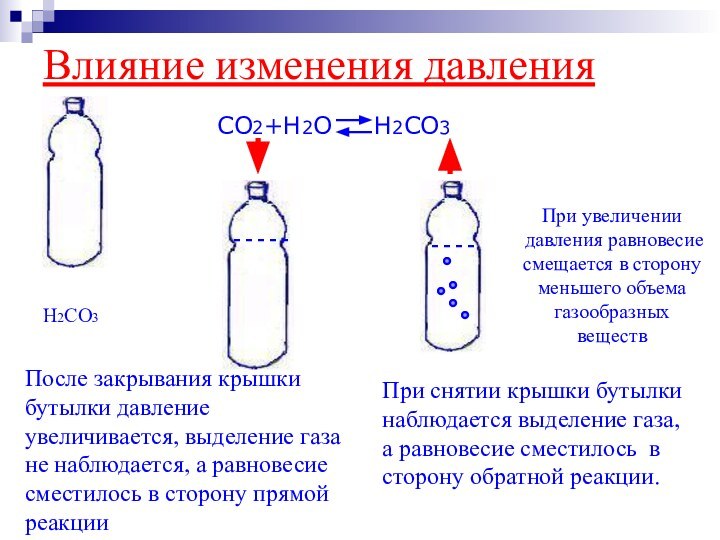
Влияние изменения давления
CO2+H2O H2CO3
При снятии
крышки бутылки наблюдается выделение газа, а равновесие сместилось в
сторону обратной реакции.При увеличении давления равновесие смещается в сторону меньшего объема газообразных веществ
H2CO3
После закрывания крышки бутылки давление увеличивается, выделение газа не наблюдается, а равновесие сместилось в сторону прямой реакции
Слайд 25
Влияние изменения концентрации
+ 2-3 капли FeCl3
+ 1-2 капли
KNCS
+ 1-2 капли KCl
При увеличении концентрации реогир. веществ
или уменьшение концентрации продукта реакции химическое равновесие смещается в сторону продуктов реакции При увеличении концентрации продуктов реакции или уменьшение концентрации реагирующих веществ химическое равновесие смещается в сторону исходных веществ.
Слайд 26
?
?
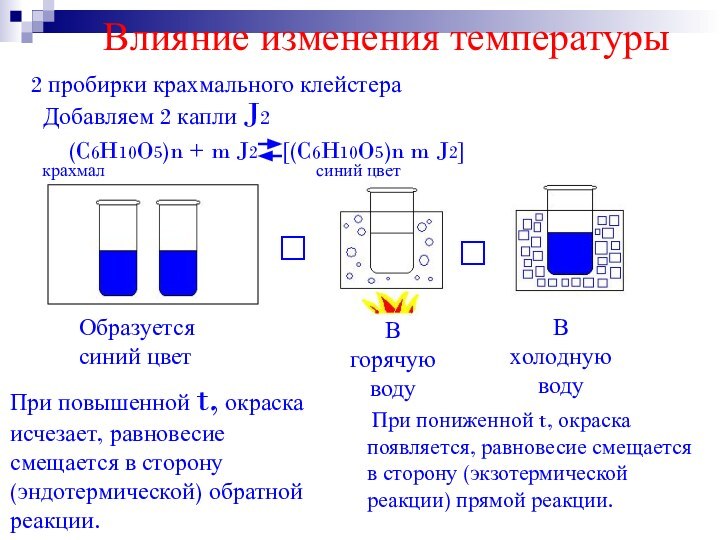
Влияние изменения температуры
2 пробирки крахмального клейстера
Добавляем 2
капли J2
При повышенной t, окраска исчезает, равновесие смещается в
сторону (эндотермической) обратной реакции. При пониженной t, окраска появляется, равновесие смещается в сторону (экзотермической реакции) прямой реакции.
Слайд 27 Как известно, в воздухе содержится 21%
кислорода (по массе). Такое количество
необходимо
для поддержания естественного равновесия:
3О2(г) ⬄ 2O3(г) - Q.
Классифицируйте данную реакцию.
Какое значение имеет озон для планеты Земля?
Используя принцип Ле Шателье предложите
условия, при которых равновесие будет
смещаться в сторону образования озона.
Слайд 28
Принцип Ле Шателье широко используется в
химической технологии
для
повышения выхода продукта производства.
Согласуется ли процесс переноса кислорода
в организме с принципом Ле Шателье
(ответ обоснуйте)?
Hb + O2 ⬄ HbO2
Слайд 29
Тесты
I Репродуктивный уровень: тесты с альтернативными ответами, в
которых испытуемый должен ответить да или нет.
1.Реакция горения
фосфора- обратимая реакция ?а) да б) нет
2.Реакция разложения карбоната кальция- это обратимая реакция?
а) да б) нет
Слайд 30 Тесты с множественным выбором правильного ответа, при выполнении
которых испытуемому необходимо выбрать 2 -3 правильных ответа, или
сопоставить 2 предложенных условия при выборе ответа.
Слайд 31
тесты
* Тесты с выбором одного правильного ответа
6. В
какой системе при повышении давления химическое равновесие сместится вправо?
1) 2HI(г)↔H2(г)+I2(г)
2) N2 + О2↔ 2 NО
3) C3 H6(г)+H2(г)↔С3 H8(г)
4) H2(г)+F2(г)↔2HF(г)
Слайд 32
Тесты
Тесты с множественным выбором правильного ответа, при выполнении
которых испытуемому необходимо выбрать 2 -3 правильных ответа, или
сопоставить 2 предложенных условия при выборе ответа.
Слайд 33
тесты
16. Укажите верное суждение : А) в обратимых
прцессах скорость прямой реакции в период от начала реакции
до достижения равновесия уменьшается; Б) в обратимых процессах скорость прямой реакции после достижения равновесия равна нулю.1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны