- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему со2
Содержание
- 2. Будова молекули СО2 Формується при з'єднанні двох елементів: вуглецю і кисню.
- 3. Фізичні властивості вуглекислого газуОксид вуглецю (IV) –
- 4. Утворення оксиду вуглецю (IV)У промисловості – побічний
- 5. Біологічні властивості Діоксид вуглецю грає одну
- 6. Застосування оксиду вуглецю (IV)Отримання цукру.Гасіння пожежі.Виробництва фруктових
- 7. У харчовій промисловості діоксид вуглецю використовується як консервант і позначається на упаковці під кодом Е290
- 8. Будова молекули СО
- 9. Моноокси́д вуглецю́ -карбону (II) оксид,, чадний газ,
- 10. Головним чином чадний газ застосовують,
- 11. ОтруйністьЧерез свою отруйність монооксид вуглецю є дуже
- 13. Парниковий ефект
- 14. Парнико́вий ефе́кт — явище в атмосфері Землі,
- 15. Парниковий ефект є природнім процесом, який необхідний
- 16. Парникові газиВодяна пара – основний природний парниковий
- 17. Звідки беруться парникові гази?Кількість СО2 в
- 18. Проблеми, пов'язані з парниковим ефектомПідвищення рівня Світового
- 19. Позитивні наслідки парникового ефектуЗбільшення тривалості вегетативного періоду
- 20. Скачать презентацию
- 21. Похожие презентации
Будова молекули СО2 Формується при з'єднанні двох елементів: вуглецю і кисню.



















Слайд 3
Фізичні властивості вуглекислого газу
Оксид вуглецю (IV) – вуглекислий
газ, газ без кольору і запаху, важчий за повітря,
розчинний у воді, при сильному охолодженні кристалізується у вигляді - «сухого льоду». При атмосферному тиску він не плавиться, а випаровується, температура сублімації -78 °С. Вуглекислий газ утворюється при гнитті і горінні органічних речовин. Міститься в повітрі і мінеральних джерелах, виділяється при диханні тварин і рослин. Мало розчинний у воді.
Слайд 4
Утворення оксиду вуглецю (IV)
У промисловості – побічний продукт
при виробництві вапна.
В лабораторії при взаємодії кислот з крейдою
або мармуром.При згорянні вуглецевмісних речовин.
При повільному окисленні в біохімічних процесах (дихання, гниття, бродіння).
Слайд 5
Біологічні властивості
Діоксид вуглецю грає одну з
головних ролей в живій природі, беручи участь в багатьох
процесах метаболізму живої клітини. Діоксид вуглецю виходить в результаті безлічі окислювальних реакцій у тварин, і виділяється в атмосферу з диханням. Вуглекислий газ атмосфери — основне джерело вуглецю для рослин.
Слайд 6
Застосування оксиду вуглецю (IV)
Отримання цукру.
Гасіння пожежі.
Виробництва фруктових вод.
«Сухий
лід».
Отримання миючих засобів.
Одержання ліків.
Отримання соди, яку використовують для одержання
скла.Слайд 7 У харчовій промисловості діоксид вуглецю використовується як
консервант і позначається на упаковці під кодом Е290
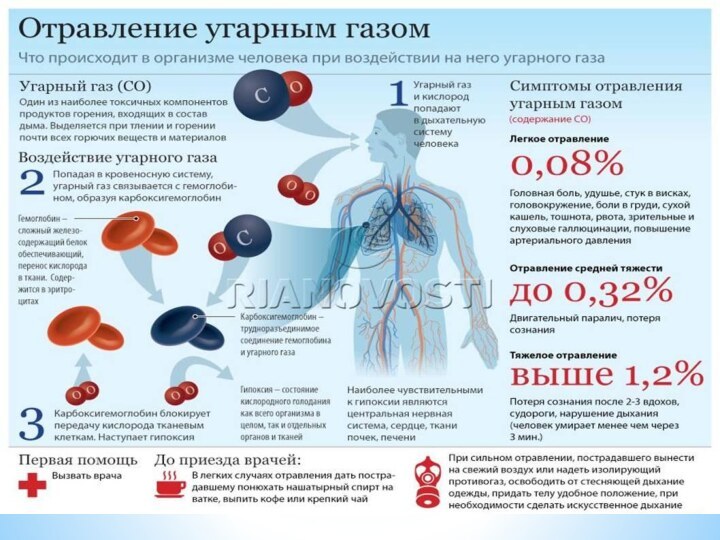
Слайд 9 Моноокси́д вуглецю́ -карбону (II) оксид,, чадний газ, CO —
безбарвний, дуже отруйний газ без запаху. Утворюється внаслідок неповного згоряння пального
в автомобільних двигунах чи в опалюваних приладах, які працюють на вугіллі або на інших видах природного палива. У воді майже не розчиняється і не вступає з нею в хімічну взаємодію. Належить до несолетворних оксидів.Фізичні властивості чадного газу
Слайд 10 Головним чином чадний газ застосовують, як горючий газ
в суміші з азотом, так званий генераторний або повітряний
газ, або в суміші з воднем - водяний газ. У металургії для відновлення металів із їх руд. Для отримання металів високої чистоти при розкладанні карбонилов.Застосування оксиду вуглецю (II)
Слайд 11
Отруйність
Через свою отруйність монооксид вуглецю є дуже небезпечним
для організму людини. Ця небезпека збільшується тим, що він
не має запаху і отруєння може настати непомітно. Навіть незначні його кількості, що потрапляють у повітря і вдихаються людиною, викликають запаморочення і нудоту, а вдихання повітря, в якому міститься 0,3 % CO за об'ємом, може швидко привести до смерті. Отруйна дія CO обумовлюється тим, що він утворює з гемоглобіном крові порівняно стійку сполуку — карбогемоглобін, внаслідок чого кров втрачає здатність передавати кисень тканинам організму. Отруєння цим газом наступає в результаті критичної нестачі кисню в організмі.Концентрація СО в повітрі 1 мг/м³ є небезпечною для життя людини. При отруєнні монооксидом вуглецю рекомендується вдихання свіжого повітря протягом кількох годин, а також штучне зігрівання тіла. При цьому карбогемоглобін поступово руйнується і гемоглобін відновлює свою здатність сполучатися з киснем.Слайд 14 Парнико́вий ефе́кт — явище в атмосфері Землі, при
якому енергія сонячних променів, відбиваючись від поверхні Землі, не
може повернутися в космос, оскільки затримується молекулами різних газів.Слайд 15 Парниковий ефект є природнім процесом, який необхідний для
підтримання життя на нашій планеті.
Парниковий ефект став світовою проблемою
в результаті надмірно великих антропогенних викидів природних та штучних парникових газів.Якщо викиди парникових газів залишиться на сьогоднішньому рівні, це може викликати значні зміни клімату як в регіонах так і в усьому світі.
Що собою являє парниковий ефект
Слайд 16
Парникові гази
Водяна пара – основний природний парниковий газ,
який відповідає більш ніж за 60 % ефекту.
Вуглекислий газ(CO2)-
джерелами вуглекислого газу в атмосфері Землі є вулканічні викиди, життєдіяльність організмів, діяльність людини.Метан (CH4)- основними антропогенними джерелами метану є травна ферментація у тварин, вирощування рису, горіння біомаси.
Озон (О3).
Флуорохлорні вуглеводні (фреони).
Оксиди Нітрогену.
Слайд 17
Звідки беруться
парникові гази?
Кількість СО2 в атмосфері постійно
зростає вже більше століття, тому що в якості джерела
енергії почали широко застосовувати різні види викопного палива (вугілля,нафта).Крім того, як результат діяльності людини в атмосферу потрапляють і інші парникові гази. Не дивлячись на те, що вони виробляються в менших об'ємах, деякі з газів куди більш небезпечні з точки зору глобального потепління, ніж вуглекислий газ.
За останні сто років середньорічна глобальна температура піднялась на 0,3 - 0,6 градусів Цельсія.
Слайд 18
Проблеми, пов'язані з парниковим ефектом
Підвищення рівня Світового океану.
Зміни
характеру хмарності й пов'язані з цим кліматичні зміни.
Зміна розподілу
опадів за регіонамиЗміна освітленості (глобальне потемніння)
Багато рослин загине від нестачі вологи і тварини будуть змушені переселитись в інші місця в пошуках їжі та води.
Якщо підвищення температури приведе до загибелі багатьох рослин, то за рослинами загине і багато видів тварин.