восстановитель
1 Вариант
С + О2 = СО2
SO3 + H2O
= H2SO42Fe2O3+3C =4Fe+3CO2
CuO+H2S=CuS+H2O
2 Вариант
NaOH + HCl = NaCl + H2O
CH4 = C + 2H2
Сu(OH)2 = CuO + H2O
Fe2O3 + 2Al = Al2O3 + 2Fe
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




2 Вариант
NaOH + HCl = NaCl + H2O
CH4 = C + 2H2
Сu(OH)2 = CuO + H2O
Fe2O3 + 2Al = Al2O3 + 2Fe
2 Вариант
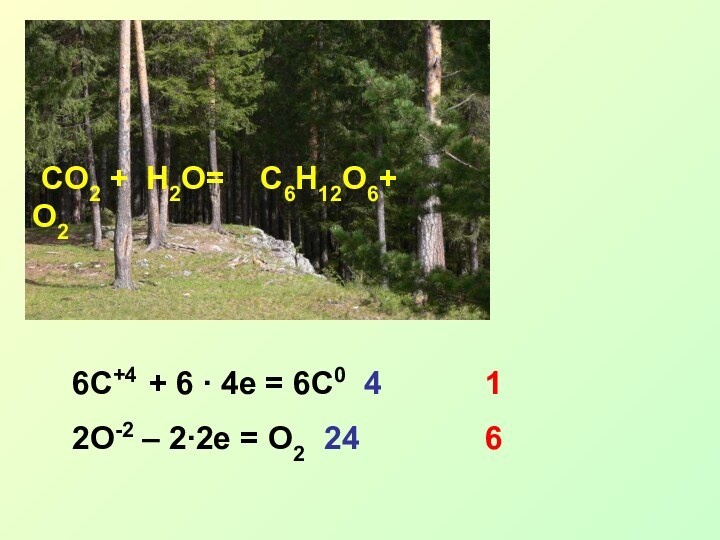
C-4H4+ = C0 + 2H20
C-4 – 4e = C0 - ок-ие, в-ль
H+ + 1e = H0 - в-ие, ок-ль
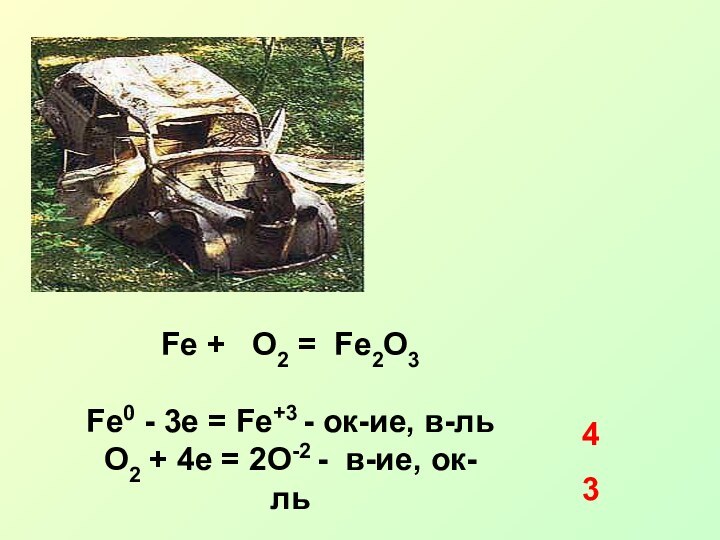
Fe2+3O3 + 2Al0 = Al2+3O3 + 2Fe0
Al0 -3e =Al+3 - ок-ие, в-ль
Fe+3 + 3e = Fe0 - в-ие, ок-ль