2S
2) S8
3) 3H2O
4) Al2O3
5) 2Al
6) CuO
1) свободные атомы
2) простые
вещества3) сложные вещества
1
2
3
3
1
3
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть










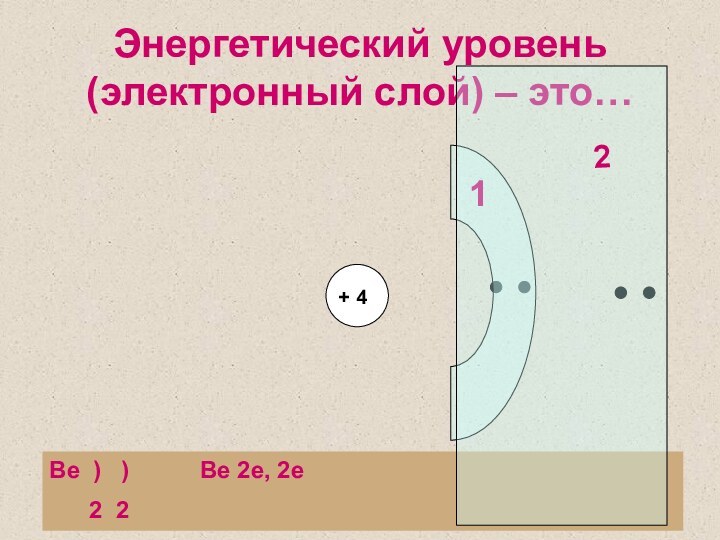






1
2
3
3
1
3
Вариант 2
1) Атомное ядро состоит из ….
2) Изотопы отличаются количеством …..
3) Массовое число атома – это сумма масс частиц ….
4) Число ….. = числу .... = порядковому номеру элемента.
5)Электрон обозначается …., имеет заряд …., массу приблизительно равную ….
6) Запишите с помощью условных обозначений состав атома меди.
Вариант 2
1) протонов и нейтронов
2) нейтронов
3) протонов и нейтронов
4) протонов = электронов
5)е, -1, 0
6) P = 29, n = 35, e = 29
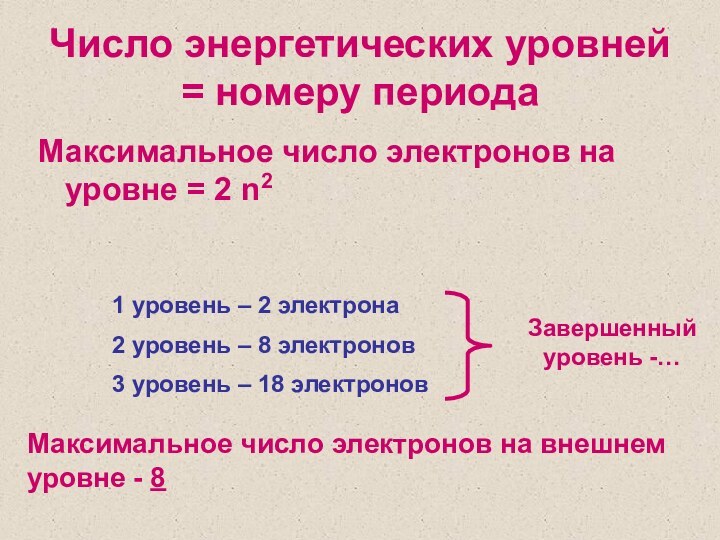
3 уровень – 18 электронов
Максимальное число электронов на внешнем уровне - 8
Завершенный уровень -…
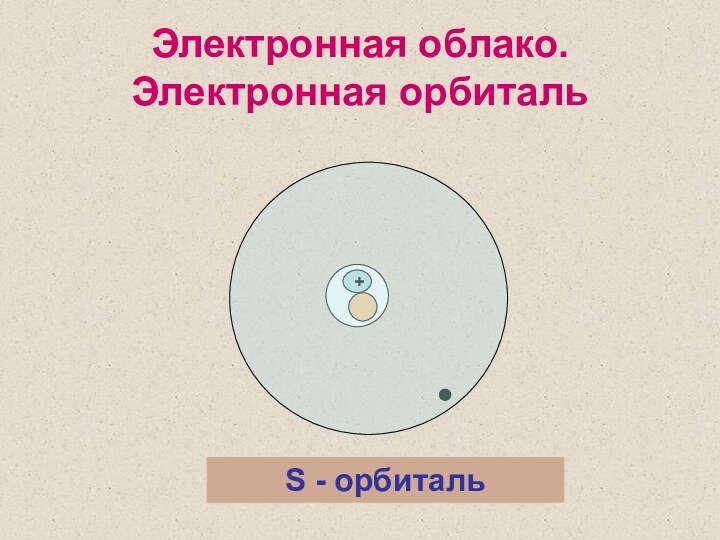
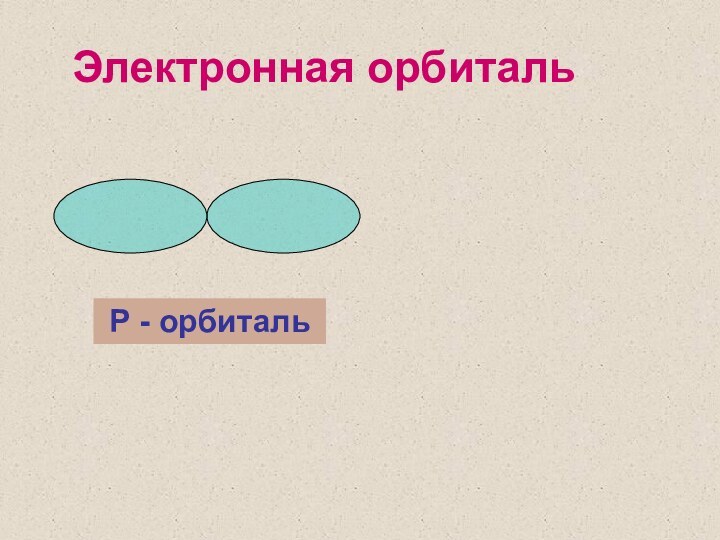
2 уровень – S, P - орбитали