и веществ металлов
3. Взаимосвязь строения металлов
и физических свойств
ПЛАН
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть































ПЛАН
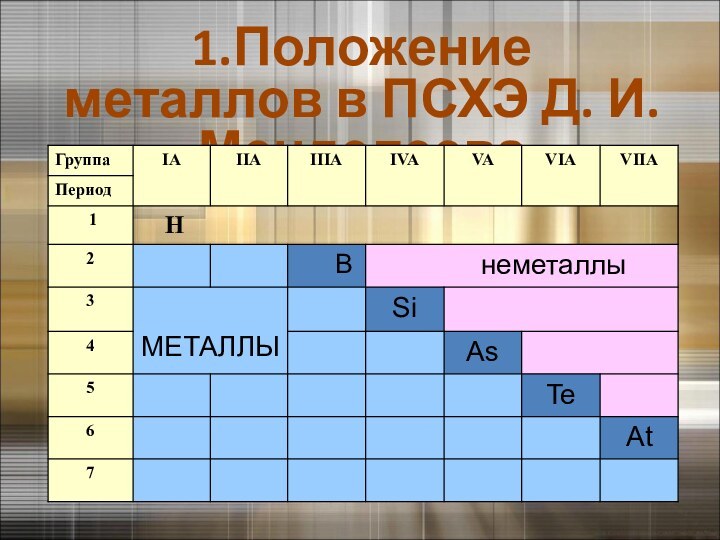
2.Строение атомов металлов и веществ металлов
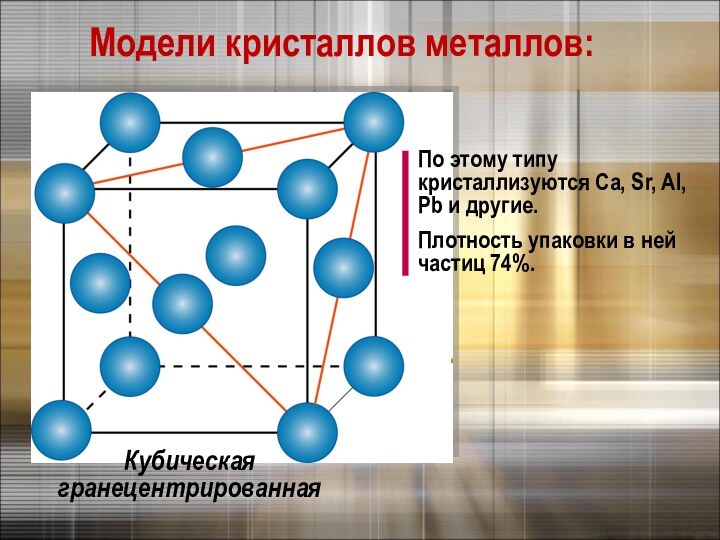
Химическая связь в металлах
2.Строение атомов металлов и веществ металлов
2. Электропроводность
и теплопроводность
3. Физические свойства металлов
2. Электропроводность
и теплопроводность
3. Физические свойства металлов
Платина и золото – одни из тяжёлых металлов
3. Физические свойства металлов