- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Минералы алюминия
Содержание
- 2. Корунд (Al2O3). Минерал, встречается в виде
- 3. Боксит(Al2O3*H2O). Боксит состоит в основном из гидратов
- 4. Нефелин(AlSiO4). Минерал широкого распространения в земной коре. Его можно
- 5. Характеристика алюминия.1) Отличается высокой
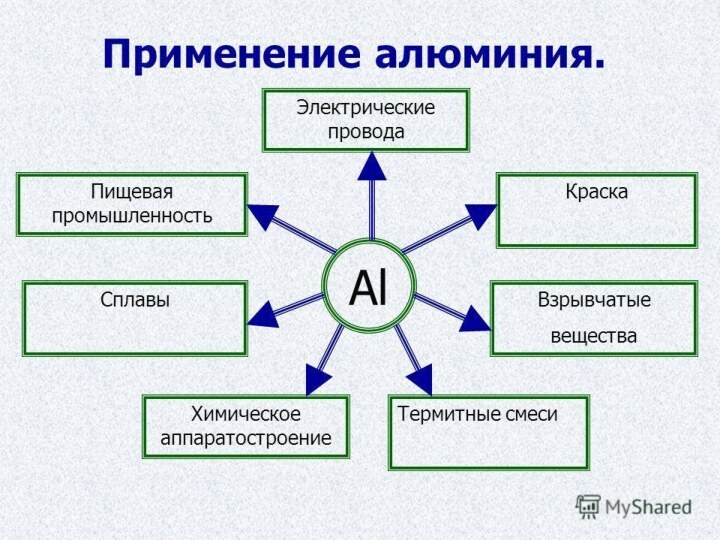
- 6. Получение и применение.Метод получения заключается
- 7. Взаимодействие
- 8. Взаимодействие с кислотами. Алюминий активно
- 9. Взаимодействие со щелочами. Алюминий в водном растворе
- 10. Скачать презентацию
- 11. Похожие презентации
Корунд (Al2O3). Минерал, встречается в виде отдельных или сросшихся в группы бочонкообразных или таблитчатых кристаллов. Плотность 3,9 4 г/см³. Температура плавления 2050 °C. Цвет варьирует от бесцветного до различных оттенков. Благодаря высокой твердости, используют как









Слайд 3 Боксит(Al2O3*H2O). Боксит состоит в основном из гидратов глинозема, окислов
железа. Основной химический компонент боксита – глинозем. Наибольшее значение боксит
имеет как исходное сырье для получения алюминия. Бокситы используются также в производстве красок.Слайд 4 Нефелин(AlSiO4). Минерал широкого распространения в земной коре. Его можно найти в
щелочных породах в виде пластин шестиугольной формы. Нефелин используется
на заводах по производству стекла и керамики. Твердость по минералогической шкале 5,5 - 6; плотность 2,5 г/м3
Слайд 5
Характеристика алюминия.
1) Отличается высокой упругостью
и не становится хрупким при низких температурах.
2) Проводит электрический
ток и тепло лучше, чем все другие металлы.3) Устойчив к коррозии на воздухе.
4) Очень устойчив к кислороду и воде.
5) Хорошо поддаётся резанию и сжатию.
6) Температура кипения около 2450°C
7) Легко растворяется в соляной и разбавленной серной кислотах.
Слайд 6
Получение и применение.
Метод получения заключается в
растворении оксида алюминия в расплаве криолита электролизом с использованием
электродов. Это требует больших затрат электроэнергии, и поэтому оказался востребован только в 20 веке.Внедрение алюминиевых сплавов в строительстве уменьшает металлоемкость, повышает долговечность и надежность. Алюминий называют главным металлом авиационной техники, он нужен в транспортном машиностроении, судостроении, в химической промышленности и электротехнике.
Слайд 7 Взаимодействие с галогенами.
ё
Алюминий бурно реагирует со всем галогенами – фтором F, хлором Cl, бромом Br и иодином I
Реакции водорода со фтором, хлором, бромом и иодином:
2Al + 3F2 → 2AlF3
2Al + 3Cl2 → 2AlCl3
2Al + 3Br2 → Al2Br6
2Al + 3l2 → Al2I6
Слайд 8
Взаимодействие с кислотами.
Алюминий активно вступает в
реакцию с разбавленными кислотами: серной, соляной и азотной, с
образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.Реакции алюминия с разбавленными кислотами:
2Al + 3H2SO4 —> Al2(SO4)3 + 3H2 2Al + 6HCl —> 2AlCl3 + 3H2 2Al + 6HNO3 —> 2Al(NO3)3 + 3H2