- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
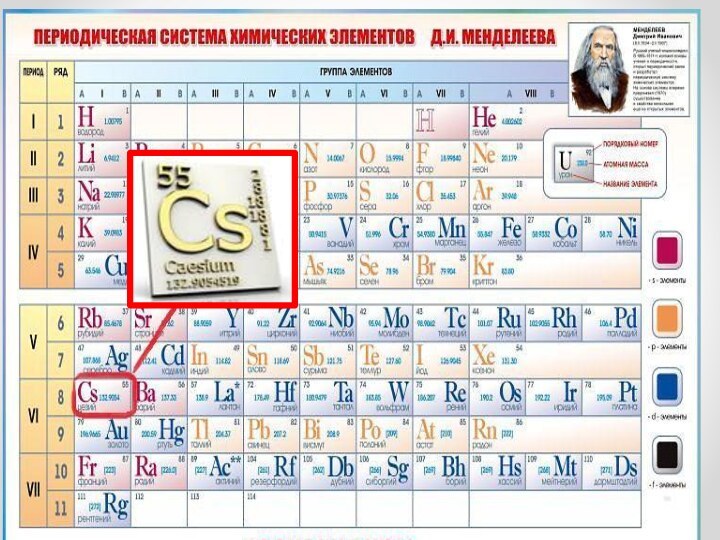
Презентация на тему Цезий
Содержание
- 3. Очень мягкий вязкий серебристо-жёлтый, похожий на золото металл
- 4. Кристаллическая решётка простого веществаСтруктура решётки кубическая объёмноцентрированная
- 5. Цезий был открыт в 1860 году немецкими
- 6. Физические свойстваПлотность - 1,90 г/см3Температура плавления - 28,5 CТемпература кипения 667,6 °C
- 7. Химические свойстваЦезий является наиболее химически активным металлом;Является
- 8. Энергично взаимодействуют со многими неметаллами:2Cs + Сl2
- 9. ПолучениеОсновными цезиевыми минералами являются:Поллуцит
- 10. Существует несколько лабораторных методов получения цезия. Он
- 11. Нахождение в природеВ природе встречается исключительно в виде соединений, является наименее распространенным металлом
- 12. ПрименениеВ электроникеВ радио-, электро-, рентгенотехникеВ химической промышленностиВ медицинеВ ядерной энергетике
- 13. Скачать презентацию
- 14. Похожие презентации
Очень мягкий вязкий серебристо-жёлтый, похожий на золото металл











Слайд 6
Физические свойства
Плотность - 1,90 г/см3
Температура плавления - 28,5
C
Температура кипения 667,6 °C
Слайд 7
Химические свойства
Цезий является наиболее химически активным металлом;
Является сильным
восстановителем;
На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид
CsO2.При ограниченном доступе кислорода окисляется до оксида Cs2O.
Взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид CsOH и водород H2.
2Cs + 2H2O = 2CsOH + H2
Слайд 8
Энергично взаимодействуют со многими неметаллами:
2Cs + Сl2 =
2CsСl (хлорид рубидия)
2CS + S = Cs2S (сульфид рубидия)
2Cs
+ Н2 = 2CsH (гидрид рубидия)Цезий растворяется почти во всех кислотах с образованием большого количества солей:
2Cs + 2НСl = 2CsСl + Н2
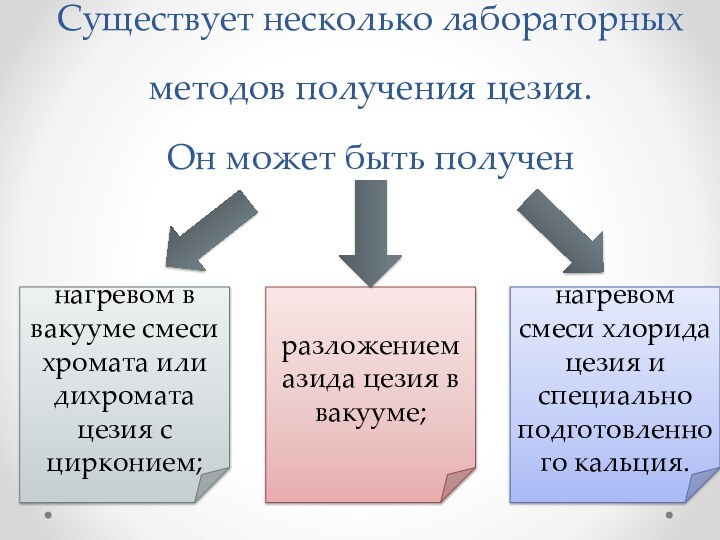
Слайд 10 Существует несколько лабораторных методов получения цезия. Он может быть
получен
нагревом в вакууме смеси хромата или дихромата цезия с
цирконием;разложением азида цезия в вакууме;
нагревом смеси хлорида цезия и специально подготовленного кальция.