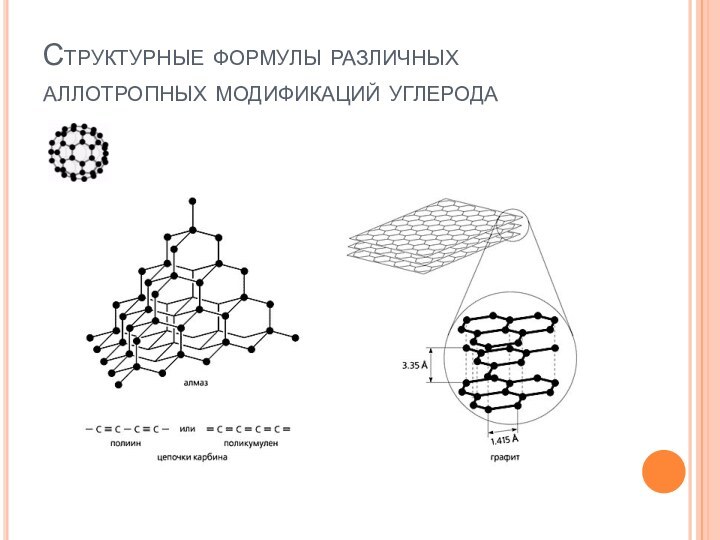
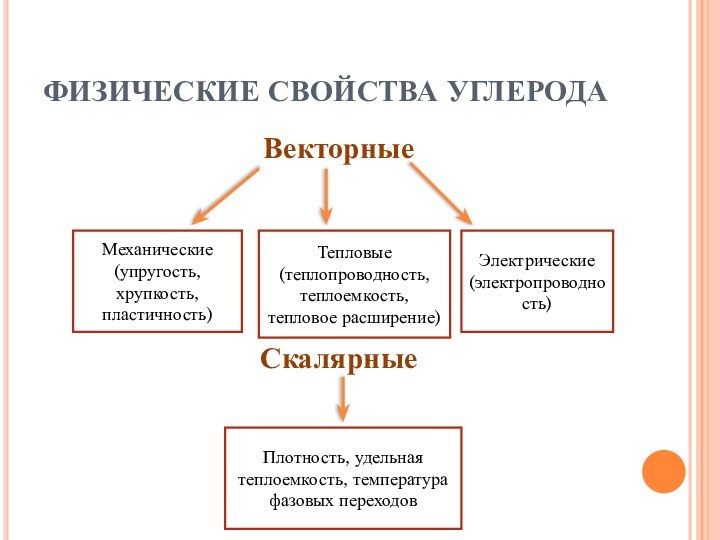
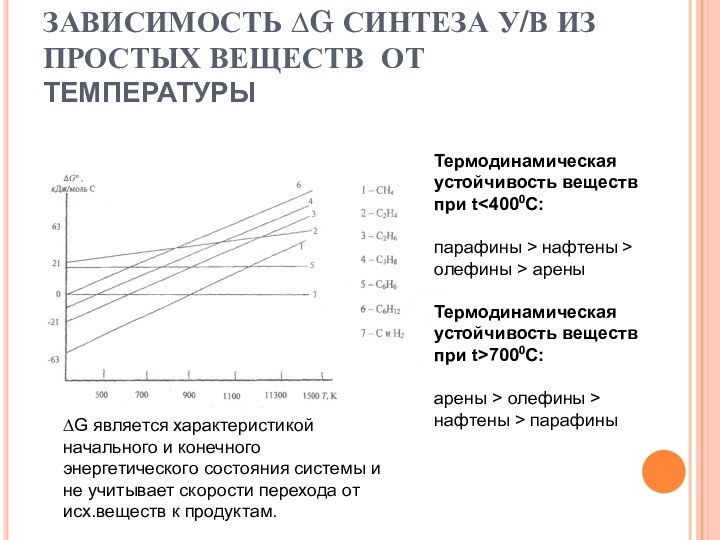
и углеродных материалов. – М.: РХТУ, 1999
Потехин В.М.,Потехин В.В.
Основы теории химических процессов технологии органических веществ и нефтепереработки. Учебник для вузов-С.-П.:Химиздат, 2007.-994 с. (гриф УМО). Ахметов А.С., Ишмияров М.Х., Кауфман А.А. Технология переработки нефти, газа и твердых горючих ископаемых. Учебное пособие. СПб Недра, 2009.–832 с (гриф УМО).
Химия нефти и газа под ред. В.А. Проскурякова и А.Е. Драпкина.Учебное пособие для вузов.-Л.:Химия, 1995.-495с. (гриф УМО).
Мановян А.К. Технология переработки природных энергоносителей, 2004
Вержичинская С.В., Дигуров Н.Г. Химия и технология нефти и газа, 2007
А.И.Левашова, А.В. Кравцов Химия природных энергоносителей и углеродных материалов. – Томск: ТПУ, 2008.-119 с.
А.И.Левашова, Н.В. Ушева Химия природных энергоносителей и углеродных материалов. Примеры и задачи. – Томск: ТПУ, 2008-92 с.