VIA группы периодической системы
Элементы этой группы имеют общее
название - ХАЛЬКОГЕНЫ, что означает «рождающие руды»ВАСИЛИЙ КАДЕВИЧ 2008г.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть












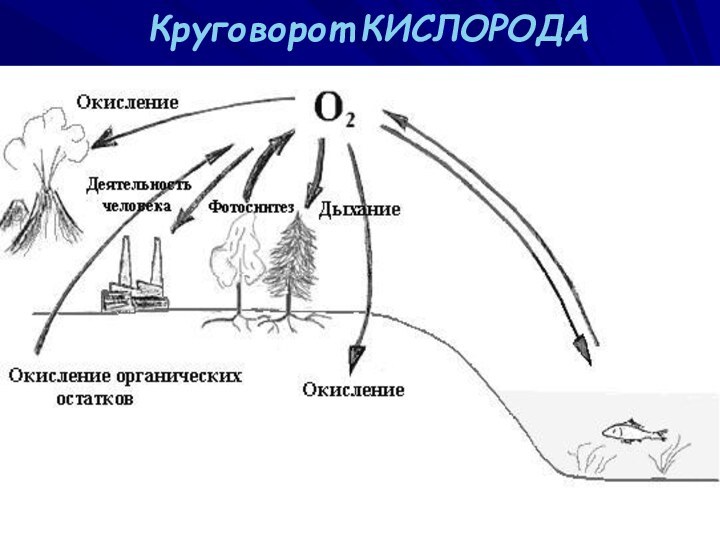


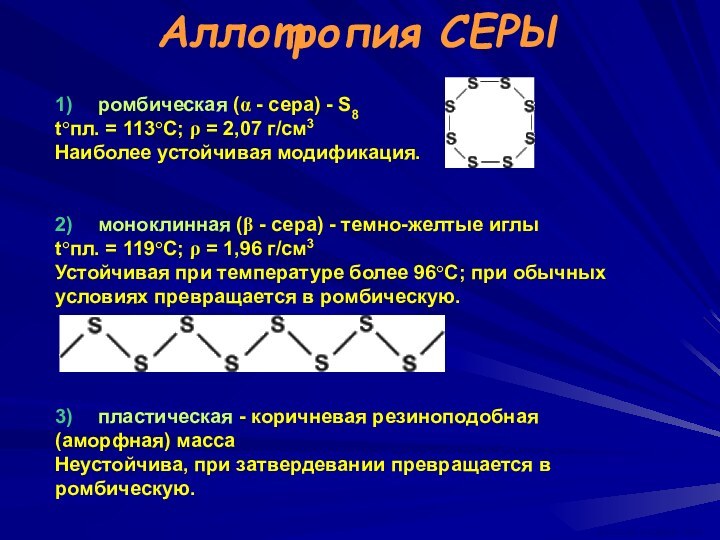



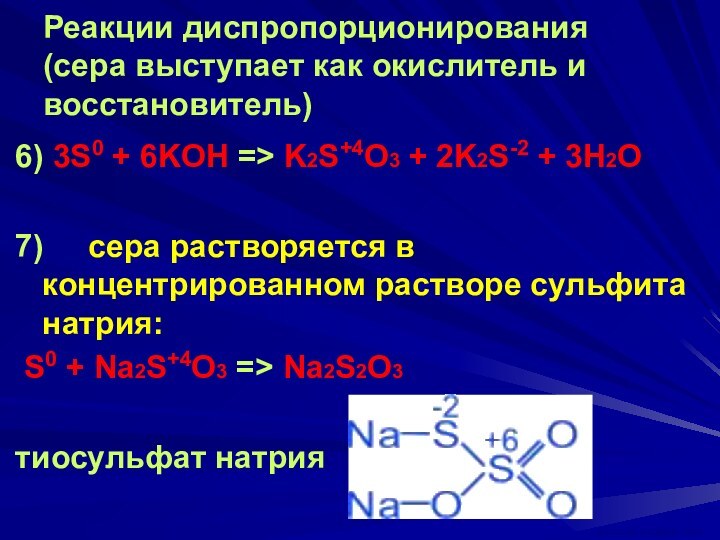
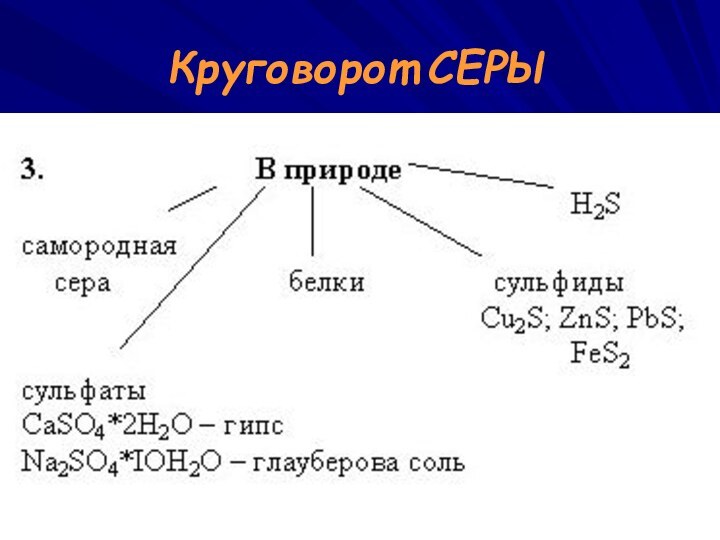



ВАСИЛИЙ КАДЕВИЧ 2008г.
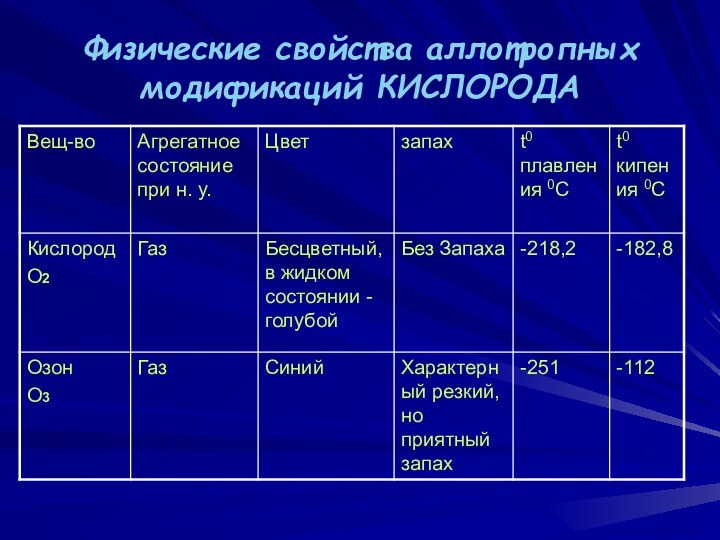
Степени окисления КИСЛОРОДА:
-2, 0, +2
Валентность
кислорода
равна двум (может быть 3 и 4 с учётом донорно-акцепторных
связей)
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.
ВАСИЛИЙ КАДЕВИЧ 2008г.