- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Углеводы - 2
Содержание
- 2. Содержание :1.Пути обмена глюкозо-6 фосфата в тканях2.Анаэробное
- 3. Пути метаболизма глюкозы
- 4. Гликолиз Это центральный путь энергетичекого
- 8. Первой реакцией гликолиза является фосфорилирование Гл. В
- 9. В печени, почках, поджелудочной железе
- 12. 3-я реакция - Фосфофруктокиназная (ФФК)
- 13. Различают регуляторную и субстратную концентрацию АТФ. Км
- 14. При снижении этого коэффициента интенсивность гликолиза увеличивается.
- 15. 4
- 16. 4-я реакция обратима. Фермент-альдолаза Разрыв связи происходит
- 18. Именно в силу последнего
- 19. Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один в другой триозофосфатизомеразой [5].
- 21. Определение активности альдолазы
- 22. Таким образом заканчивается первый подготовительный
- 23. II этап гликолиза – гликолитическая
- 25. В этой реакции в молекулу
- 26. На
- 28. Следующий промежуточный продукт, гидролиз которого
- 30. Далее происходит отщепление воды
- 32. На последней стадии, которая катализируется
- 34. При гликолизе на активацию одной
- 35. Ферменты гликолиза, кроме альдолазы нуждаются ионах Мg++
- 36. Изменение энергии системы
- 37. Энергетический баланс гликолиза В 1-й стадии
- 38. Биологическое значение гликолиза 1. Филогенетически самый древний
- 39. 4.Роль гликолиза для отдельных клеток. В
- 40. В эритроцитах гликолиз это единственный
- 41. Контроль гликолиза осуществляется ЛДГ и
- 42. В анаэробных тканях( печень, мышцы)
- 43. Механизм гликолитической оксидоредукции. Субстратное фосфорилирование
- 44. 3ФГК1,3 ДФГК 3 ФГА 2
- 45. Это цикл гликолитической оксидоредукции.
- 46. Кроме этих двух существует еще
- 47. Спиртовое брожение В тканях различных организмов
- 48. глюкоза
- 49. Этанол является уникальным веществом,т.к. представлен
- 52. Введение этанола приводит к сдвигам
- 53. Пути метаболизма этанола NAD+; АлДГ1.СН3СН2ОН
- 54. Дальнейшее окисление ацетальдегида:
- 55. 2. Путь обезвреживания этанола через Микросомальную систему
- 56. 3.путь обезвреживания этанола – пероксидазный, минорный
- 57. Метаболические последствия интоксикации этанолом Этанол лимитирует
- 58. При приеме этанола увеличивается активность
- 59. Этанол хорошо растворяется в воде
- 60. ЖК должны окисляться под
- 62. Второй причиной яв-ся образование ацетил-КоА,
- 63. Аэробный гликолиз.
- 64. Аэробный гликолиз. При анаэробном гликолизе ПВК
- 65. Метаболизм ПВК
- 66. Пируват, образовавшийся в реакциях гликолиза (в цитоплазме),
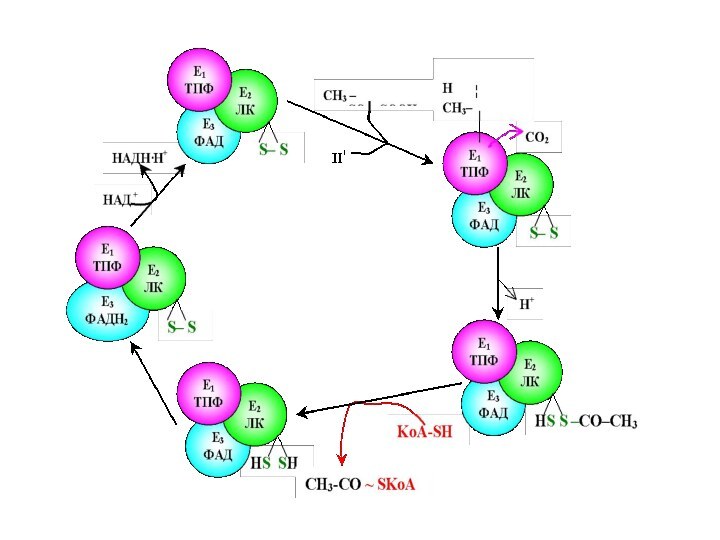
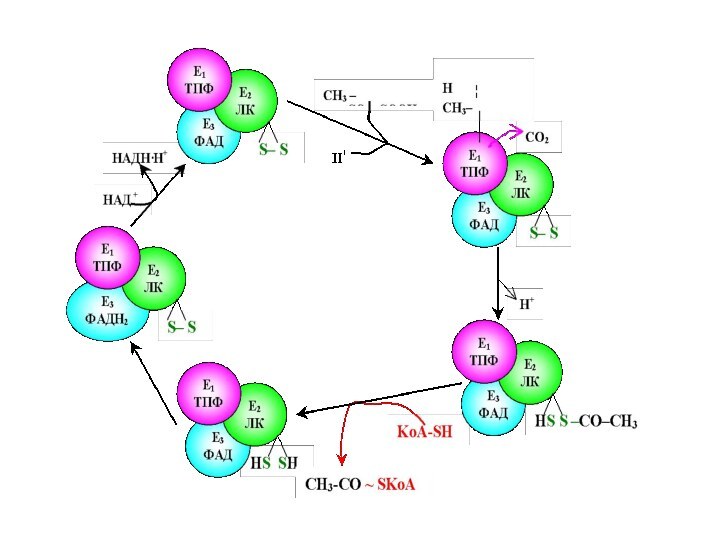
- 67. Пируватдегидрогеназный комплекс включает три фермента: пируватдегидрогеназу,липоатацетил-
- 69. Пируватдегидрогеназа состоит из 60 полипептидных
- 71. Е1 катализирует декарбоксилирование ПВК с участием кофермента
- 72. Дисульфидная группа липоевой кислоты способна восстанавливаться и
- 73. Наконец, начинает функционировать Е3, коферментом
- 74. Таким образом, в окислительном декарбоксилировании
- 76. Образующийся ацетил-КоА затем окисляется в
- 77. При недостаточном содержании в диете
- 78. При выраженном дефиците тиамина развивается некомпенсированный ацидоз, который без лечения приводит к летальному исходу.
- 79. При низкой концентрации инсулина и высоком уровне
- 80. Цикл Кребса – центральный путь обмена веществ.
- 82. Эффект Пастера –подавление гликолиза дыханием впервые было
- 83. Гликогенолиз
- 84. гликоген Н3РО4 Гл-1-ф
- 85. В процессе гликогенолиза в виде
- 86. Скачать презентацию
- 87. Похожие презентации
Содержание :1.Пути обмена глюкозо-6 фосфата в тканях2.Анаэробное расщепление глюкозы3.Спитровое брожение4.Аэробный гликолиз5.Регуляция гликолиза и гликогенолиза6.Энергетический баланс окисления углеводов.
















![Углеводы - 2 Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один в другой триозофосфатизомеразой [5].](/img/tmb/15/1421935/4fd94fe66f7ccbb6dc3a4cae10b4c25b-720x.jpg)




![Углеводы - 2 На следующей стадии (катализируемой фосфоглицераткиназой [7]),](/img/tmb/15/1421935/58cba3dabee7f13982d86eff47e6536f-720x.jpg)


![Углеводы - 2 Далее происходит отщепление воды (фермент: енолаза [9]). Продукт представляет](/img/tmb/15/1421935/6d3253a29276c9ac81cf05df56d07a41-720x.jpg)
![Углеводы - 2 На последней стадии, которая катализируется пируваткиназой [10], образуются пируват и](/img/tmb/15/1421935/794f269d9ca6f030743003b2dcdd40f7-720x.jpg)


















































Слайд 2
Содержание :
1.Пути обмена глюкозо-6 фосфата в тканях
2.Анаэробное расщепление
глюкозы
углеводов.
Слайд 3
Пути метаболизма глюкозы
С6Н12О6 +
инсулиновый стимулГлюкозо 6 фосфат
ПВК
лактат
ГНГ
Гликоген, резерв
ПФП
ГАГ
Ацетил-SКоА
ЦТК
БО
СО2
Н2О
Слайд 4
Гликолиз
Это центральный путь энергетичекого обмена
протекает без окислительных реакций.
В анаэробных
условиях –гликолиз единственный процесс, поставляющий энергию. Протекает практически во всех тканях. Уровень активности зависит от аэрации и оксигенации тканей
Слайд 8
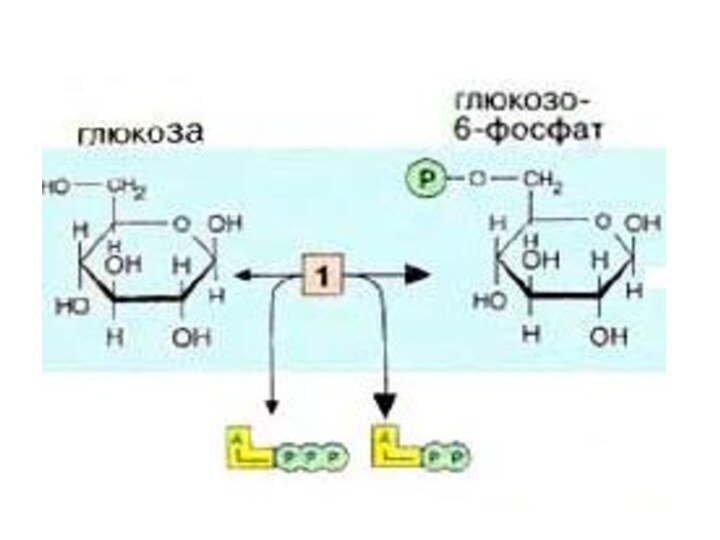
Первой реакцией гликолиза является фосфорилирование Гл.
В результате
этой реакции образуется большое количество энергии, которая сразу рассеивается,
поэтому р-я необратима.Гексокиназа- аллостерический ферментом и ингибируется Гл-6-ф. Она также может фосфорилировать фруктозу и маннозу.
Гексокиназа есть во всех клетках организма Км от 0.01-01ммоль/л
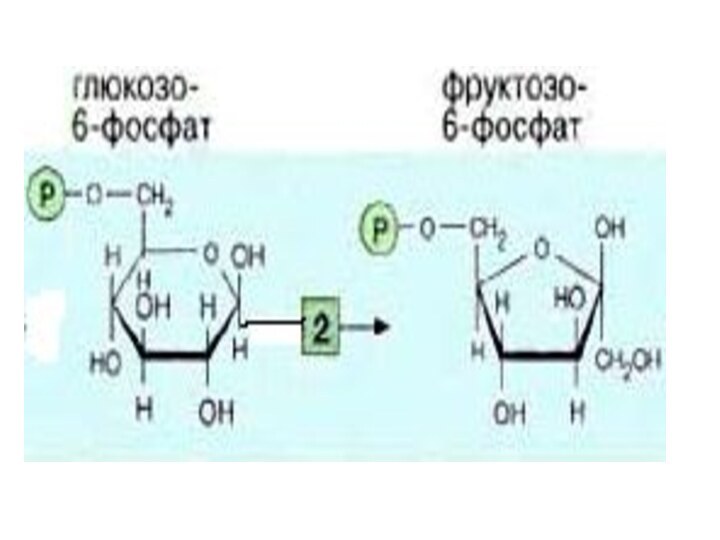
Слайд 9 В печени, почках, поджелудочной железе есть
глюкокиназа, которая катализирует только фосфорилирование глюкозы.
Она не
ингибируется Гл-6-ф. и имеет высокую Км для глюкозы ( 10 ммоль/л).2-я реакция идет в присутствии фосфогексоизомеразы.
Слайд 12 3-я реакция - Фосфофруктокиназная (ФФК) реакция
определяет скорость гликолиза в целом( т.е. является лимитирующей).
ФФК
относится к числу аллостерических ферментов.. Она ингибирует АТФ и стимулирует АДФ и АМФ.АТФ в данном случае является и субстратом и аллостерическим регулятором для ФФК
Слайд 13 Различают регуляторную и субстратную концентрацию АТФ. Км для
субстратного и регуляторного центров ФФК будут различны, и фермент
будет отслеживать уровень АТФ в более высоких концентрациях, чем АТФ в качестве субстрата. Поэтому и идет ингибирование.При значительных величинах АТФ/АДФ активность ФФК снижается и гликолиз замедляется↓.
Слайд 14 При снижении этого коэффициента интенсивность гликолиза увеличивается. Так
в неработающей мышце ( АТФ) ↑, гликолиз снижается.
Во время
работы (АТФ) ↑.ФФК ингибируется цитратом, активируется ионами СА++. Жирные кислоты, и их ацил-КоА –производные, яв-ся ингибитрами ФФК.
Слайд 16 4-я реакция обратима. Фермент-альдолаза Разрыв связи происходит в
результате напряжения между атомами С3 и С4.
Расщепляется альдоль – фруктозо-1,6-дифосфат. Равновесие реакции сдвинуто в сторону распада фруктозо-1,6-дифосфата, поскольку образующийся 3-ФГА расходуется в дальнейших реакциях гликолиза.
Слайд 18
Именно в силу последнего
обстоятельства, обратимая триозофосфатизомеразная реакция также смещается в сторону образования
3-ФГА( дальнейшие реакции гликолиза)
Слайд 19
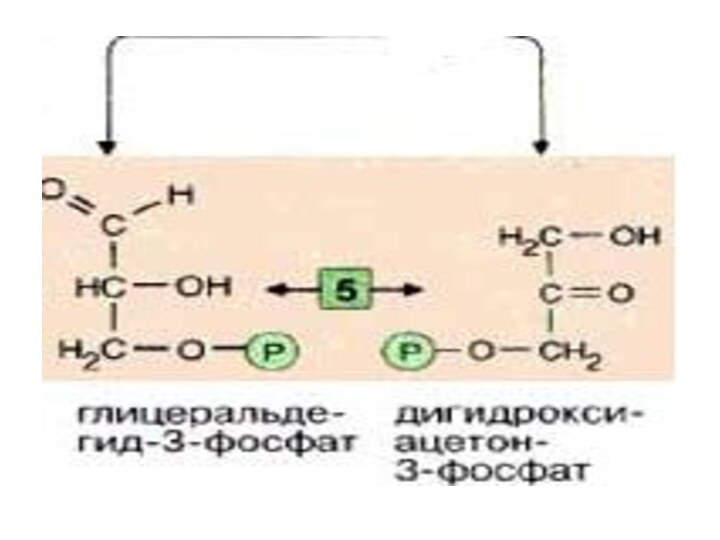
Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат
— превращаются один в другой триозофосфатизомеразой [5].
Слайд 21
Определение активности альдолазы используют
в энзимодиагностике при заболеваниях, связанных с повреждением или гибелью
клеток: так, при остром гепатите активность этого фермента может увеличиваться в 5-20 раз, при ИМ в 3-10 раз, при миодистрофии в 4-10 раз.Слайд 22 Таким образом заканчивается первый подготовительный и
энергопотребляющий этап гликолиза, связанный с вкладыванием энергии в процесс
активации субстратов.На этом этапе гликолиза фактически образуется 2 молекулы 3-ФГА.
Слайд 23
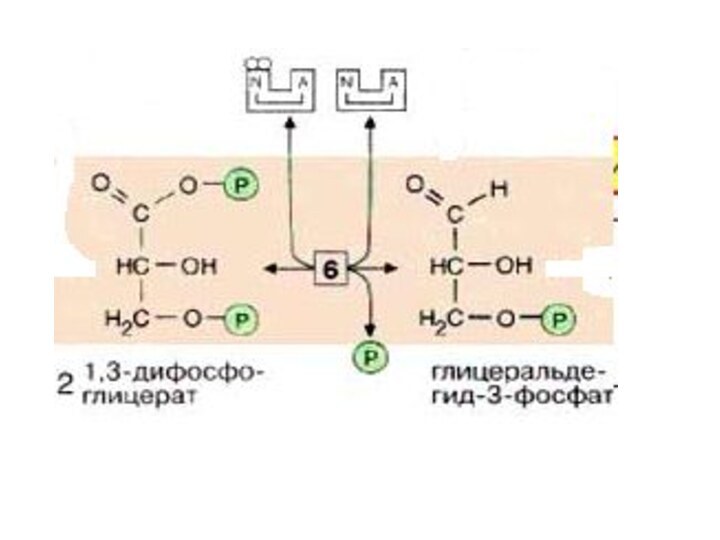
II этап гликолиза – гликолитическая оксидоредукция.
Глицеральдегид-3-фосфат затем окисляется глицеральдегид-З-фосфатдегидрогеназой [6] с
образованием НАДН+Н+. Реакция контролируется НАД+ и НАДН+Н+. Эту реакцию контролирует ↑ НАД+ и ↓ НАДН+Н+
Слайд 25 В этой реакции в молекулу включается
неорганический фосфат («субстратное фосфорилирование»,) с образованием 1,3-дифосфоглицерата- 1,3ДФГ.
Такое промежуточное соединение содержит смешанную ангидридную связь, расщепление которой является высоко экзоэргическим процессом.
Слайд 26
На следующей
стадии (катализируемой фосфоглицераткиназой [7]), гидролиз этого соединения сопряжен с
образованием АТФ. Эта реакция является -киназной и регулируется фосфоглицераткиназой( фосфотрансфераза).
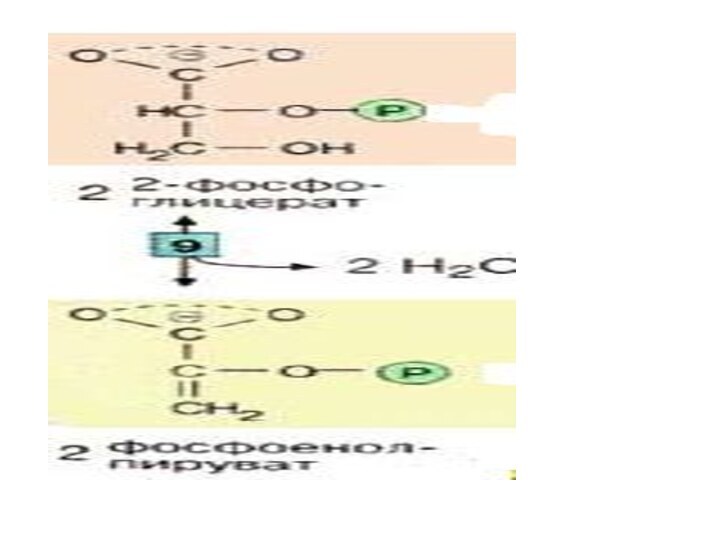
Слайд 28 Следующий промежуточный продукт, гидролиз которого может
быть сопряжен с синтезом АТФ, образуется в реакции изомеризации
3-фосфоглицерата, полученного в результате реакции [7],в 2-фосфоглицерат (фермент: фосфоглицератмутаза [8])
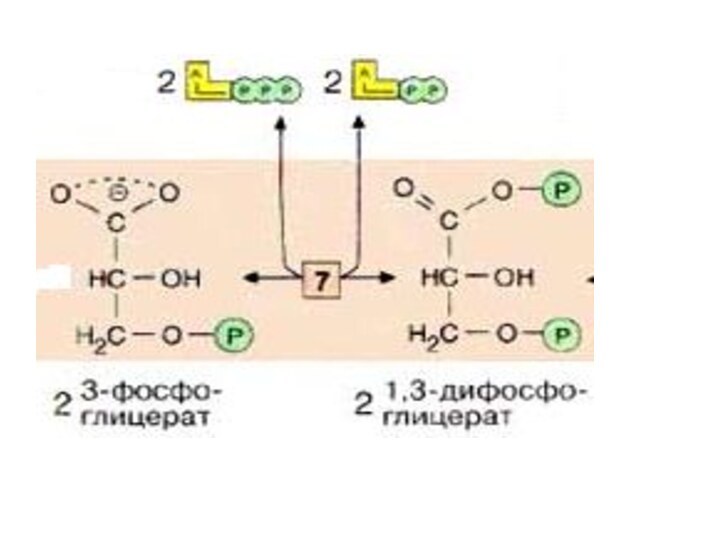
Слайд 30
Далее происходит отщепление воды
(фермент: енолаза [9]). Продукт представляет собой сложный эфир фосфорной
кислоты и енольной формы пирувата и потому называется фосфоенолпируватом (PEP).Слайд 32 На последней стадии, которая катализируется пируваткиназой
[10], образуются пируват и АТФ. Наряду со стадией [6]
и тиокиназной реакцией в ЦТК, это третья реакция, позволяющая клеткам синтезировать АТФ независимо от дыхательной цепи. Несмотря на образование АТФ она высоко экзоэргична и потому необратима.Слайд 34 При гликолизе на активацию одной молекулы
глюкозы потребляется 2 молекулы АТФ. В то же время
при метаболическом превращении каждого С3-фрагмента образуются 2 молекулы АТФ.В результате выигрыш энергии составляет 2 моля АТФ на моль глюкозы.
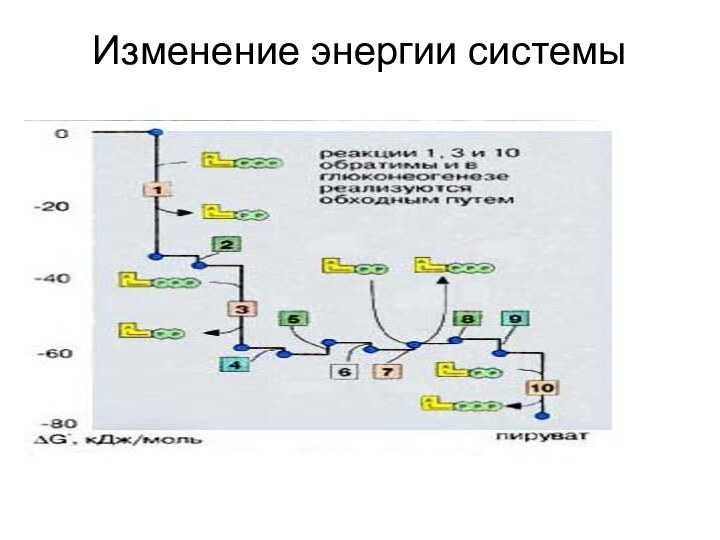
Слайд 37
Энергетический баланс гликолиза
В 1-й стадии гликолиза
затрачивается 2 молекулы АТФ ( гексокиназная и фосфофруктокиназная реакции).
Во 2-й стадии образуется 4 молекулы АТФ( фосфоглицераткиназная и пируваткиназная реакции).Т.о. энергетическая эффективность гликолиза составляет 2 мол. АТФ на 1 молекулу глюкозы.
Слайд 38
Биологическое значение гликолиза
1. Филогенетически самый древний
способ получения энергии
2.Для клеток с малым числом митохондрий
его значение особенно велико.3.Гликолиз является источником углеродных радикалов для биосинтезов ( липидов, аминокислот, глюкозы).
Слайд 39
4.Роль гликолиза для отдельных клеток.
В мышцах
гликолиз поставляет АТФ.
В гепатоцитах фрагменты гликолиза
используются в ГНГ(глюконеогенезе), а избыток глюкозы
переходит в липиды.
В клетках мозга гликолиз является
фрагментом аэробного пути
окисления.
Слайд 40 В эритроцитах гликолиз это единственный путь
получения энергии, поскольку в эритроцитах нет митохондрий.
Наследственный
дефект пируваткиназы является причиной гемолитической анемии. Если эритроциты имеют менее 25% активности фермента, то скорость гликолиза снижается.Слайд 41 Контроль гликолиза осуществляется ЛДГ и ее
изоферментами.
В тканях с аэробным метаболизмом
(
сердце, почки) преобладают ЛДГ1 и ЛДГ2. Эти ферменты ингибируют даже небольшие концентрации ПВК, что препятствует образованию лактата и способствует более полному окислению ПВК в ЦТК.Слайд 42 В анаэробных тканях( печень, мышцы) преобладает
ЛДГ4 и ЛДГ5. Активность ЛДГ5 максимальна при той концентрации
ПВК, которая ингибирует ЛДГ1.ЛДГ4 и ЛДГ5 обеспечивают интенсивное превращение ПВК в лактат.
Слайд 45 Это цикл гликолитической оксидоредукции. Ключевое
значение имеет реакция 3ФГА----? 1,3 ДФГК, механизм которой расшифрован.
Здесь также указаны пункты образования АТФ путем фосфорилирования. Они соответствуют 2-м киназным реакциям- фосфоглицераткиназной и пируваткиназной.Слайд 46 Кроме этих двух существует еще 2
киназные реакции, в них АТФ не образуется, а расходуется.
Киназные реакции гликолиза являются фосфотрансферазными, т.е. осуществляется перенос макроэргического фосфата с S на АДФ в фосфоглицераткиназной и пируваткиназной реакциях, а также с АТФ на S в гексокиназной и фосфофруктокиназной р- ях.
Слайд 47
Спиртовое брожение
В тканях различных организмов имеются
ферменты, расщепляющие глюкозу до этанола. Этот процесс называется спиртовым
брожением.Суммарное уравнение :
С6Н12О6_? 2 СО2 + 2С2Н5ОН
По своему механизму СБ очень близок к
гликолизу. Расхождение начинается лишь после образования ПВК.
Слайд 49 Этанол является уникальным веществом,т.к. представлен в
двух видах:
1. В роли эндогенного метаболита. Его концентрация
в крови= 2×10-4 до 2×10-5моль/л- это нормальная эндогенная концентрация.
2.При употреблении в больших дозах этанол выступает как ксенобиотик-чужеродный для организма агент.
Слайд 52 Введение этанола приводит к сдвигам в
нервной системе, которые обусловлены образованием продуктов конденсации СН3СОН с
биогенными аминами ( шиффовые основания), которые являются патологическими медиаторами по структуре сходными с препаратом Папаверином и называются папаверолинами.
Слайд 53
Пути метаболизма этанола
NAD+; АлДГ
1.СН3СН2ОН
алкогольдегидрогеназа ( NAD зависимая)CН3СОН – это центральный фигурант токсических эффектов этанола
NADH2
Слайд 54
Дальнейшее окисление ацетальдегида:
HSKoA
CН3СОН-----------?СН3СО SКоА---?ЦТК
↓[O]
↓СН3СООН
Н Н
| l
СН3---С =О + Н2N—R-----? СН2— С=NR
Шиффовое основание
Слайд 55 2. Путь обезвреживания этанола через Микросомальную систему окисления
в ЭПС.
P450СН3-СН2-ОН + NADFH+H+ +2O2-------------------?СН3-СОН +2Н2О
Слайд 56
3.путь обезвреживания этанола – пероксидазный, минорный каталазный
СН3-СН2-ОН +Н2О2 --*-? СН3СОН + 2Н2О
где *- каталаза
Ацетальдегид нацелен на аминогруппы(-NН2), с которыми он может образовывать шиффовые основания. За счет двойных связей происходят реакции полимеризации и образуются пигменты, обладающие морфиноподобным действием.
Слайд 57
Метаболические последствия интоксикации этанолом
Этанол лимитирует основной
фонд NAD+, переводя его в NADH, и это приводит
к блокированию I комплекса ДЦ. Клетки, чтобы не погибнуть от гипоксии вынуждены переключаться на FAD-зависимое окисление, а именно переходить на эндогенное производство сукцината из ГЛУ.Побочными продуктами ГЛУ являются ГАМК и ГОМК- медиаторы торможения.
Слайд 58 При приеме этанола увеличивается активность каталазы,которая
провоцирует перекисные процессы, следствием чего является развитие патологии печени,
сердца , НС.При хронической алкогольной интоксикации развивается жировая инфильтрация и дегенерация печени.
Слайд 59 Этанол хорошо растворяется в воде и
липидах. Он растворим в клеточных мембранах, и увеличивает их
текучесть.Введение этанола создает экстремальную ситуацию, которая во- первых, сопровождается выбросом адреналина, а значит активирует липолиз, повышает содержание жирных кислот( ЖК ), которые поступают в печень .
Слайд 60
ЖК должны окисляться под
действием NAD-зависимых ДГ,но эти реакции блокируются.
При
длительном использовании этанола, печень просто не успевает утилизировать ЖК для биосинтеза ФЛ. Поэтому ЖК накапливаются в печени.Слайд 62 Второй причиной яв-ся образование ацетил-КоА, из
этанола, который также идет на биосинтез ЖК, тем самым
усугубляя ситуацию.Аналогичные процесс протекают и в миокарде, при этом развивается синдром «жирового» сердца (слой кардиоцитов чередуется с адипоцитами).
Однако,прием этанола обеспечивает устойчивость организма к другим ядам.
Слайд 64
Аэробный гликолиз.
При анаэробном гликолизе ПВК
превращается в лактат, в случае аэробного гликолиза ПВК подвергается
окислительному декарбоксилированию с образованием Ацетил –SКоА.Аэробный гликолиз совпадает с анаэробным до стадии образования ПВК, а в дальнейшем протекает окислительное декарбоксилирование (ОД) ПВК.
Слайд 65
Метаболизм ПВК
Гл-6-ф
лактат
ПВК аланин и аналоги _____________________________Ацетил-КоА
ЦТК
Холестерин
С2Н5ОН
Кетоновые тела
ЩУК
+СО2
-СО2
ЦТК
Слайд 66
Пируват, образовавшийся в реакциях гликолиза (в цитоплазме), должен
быть транспортирован в митохондрии. Транспорт осуществляется специальной «челночной» системой.
В матриксе митохондрии, прикрепившись к её внутренней мембране, находится сложный полиферментный комплекс – пируватдегидрогеназа.
Слайд 67
Пируватдегидрогеназный комплекс включает три фермента:
пируватдегидрогеназу,липоатацетил-
трансферазу
липоамиддегидрогеназу
и пять коферментов- NAD, FAD,
тиаминдифосфат (TPP), KoA, амид липоевой кислотыСлайд 69 Пируватдегидрогеназа состоит из 60 полипептидных цепей,
которые можно разделить на 3 основных фермента: Е1 –
собственно пируватдегидрогеназа (состоит из 24 субъединиц); Е2 – дигидролипоилтрансацетилаза (также 24 субъединицы); Е3 – дигидролипоилдегидрогеназа (12 субъединицСлайд 71 Е1 катализирует декарбоксилирование ПВК с участием кофермента тиаминпирофосфата
(ТРР). Образовавшийся продукт реакции (гидроксиэтильное производное ТРР) при участии
Е2 реагирует с окисленной липоевой кислотой. Липоевая кислота – низкомолекулярное азотсодержащее соединение – является коферментом Е2.Слайд 72 Дисульфидная группа липоевой кислоты способна восстанавливаться и ацетилироваться.
В реакции, катализируемой дигидролипоилтрансацетилазой (Е2 ), образуется ацетиллипоевая кислота.
Далее это соединение реагирует с коэнзимом А (КоА-SH не является собственным коферментом Е2) – при этом образуется восстановленная форма липоевой кислоты (дигидролипоевая кислота) и ацетил-КоА.Слайд 73 Наконец, начинает функционировать Е3, коферментом которого
является ФАД: кофермент окисляет дигидролипоевую кислоту и сам при
этом восстанавливается (ФАДН2) . Восстановленный флавиновый кофермент реагирует с митохондриальным НАД+, в свою очередь, восстанавливая его (НАДН ·Н+).
Слайд 74
Таким образом, в окислительном декарбоксилировании ПВК
участвует фактически 3 фермента, составляющих единый пируватдегидрогеназный комплекс, и
5 коферментов: ТРР, липоевая кислота и FAD– собственные коферменты комплекса, КоА-SH и NAD+ – внешние, приходящие «извне».Слайд 76 Образующийся ацетил-КоА затем окисляется в цикле
Кребса, а водород с NADН ·Н+ поступает в дыхательную
цепь митохондрий.ПВК-ДГ отличается большим отрицательным редокс-потенциалом, который способен обеспечить не только восстановление NAD+, но и способствовать образованию высокоэнергетической тиоэфирной связи в ацетил-КоА (СН3-СО~ SкоА).
Слайд 77 При недостаточном содержании в диете входящих
в состав ПВК-ДГ витаминов, в первую очередьТРР, активность фермента
снижается. Это приводит к накоплению в крови и тканях пирувата и лактата и развитию метаболического ацидоза
Слайд 78
При выраженном дефиците тиамина развивается некомпенсированный ацидоз, который
без лечения приводит к летальному исходу.
Слайд 79 При низкой концентрации инсулина и высоком уровне энергообеспеченности
клетки (↑АТФ, ↑ ацетил-КоА и ↑ NADH·Н+) этот комплекс
находится в неактивном состоянии. Активирование ПВК-ДГ комплекса индуцируется инсулином, КоА-SН, пируватом, АДФ и ионами Mg++.
Слайд 80
Цикл Кребса – центральный путь обмена веществ.
Своё название
этот метаболический путь получил по имени открывшего его автора
– Ганса Кребса, получившего (совместно с Ф. Липманом) за это открытие в 1953 г. Нобелевскую премию.Слайд 82 Эффект Пастера –подавление гликолиза дыханием впервые было обнаружено
у микроорганизмов.
Эффект Кретбри- преобладание анаэробного гликолиза, например в опухолевых
клетках , при канцерогенезе.Слайд 83 Гликогенолиз и
гликолиз
Процесс анаэробного распада
гликогена получил название гликогенолиза.Образовавшийся в ходе фосфоглюкомутазной реакции Гл-6-ф, включается в процесс гликолиза.
После образования Гл-6-ф, дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
Слайд 84
гликоген
Н3РО4
Гл-1-ф
глюкоза
Гл-6-ф
Гл-6-ф
АТФ
АДФ
1
2
1.Гексокиназа или
глюкокиназа2. фосфоглюкомутаза
гликолиз
Слайд 85 В процессе гликогенолиза в виде макроэргических
соединений накапливается не две, а три молекулы АТФ, т.к.
не расходуется АТФ на образование Гл-6 ф.На первый взгляд кажется, что гликогенолиз энергетически более выгодный процесс. Но во время синтеза гликогена расходуется АТФ, поэтому гликогенолиз и гликолиз энергетически равноценны.





























