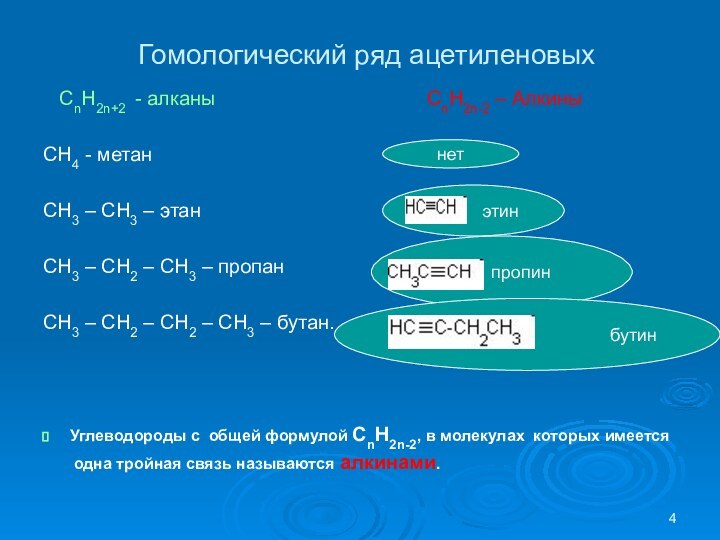
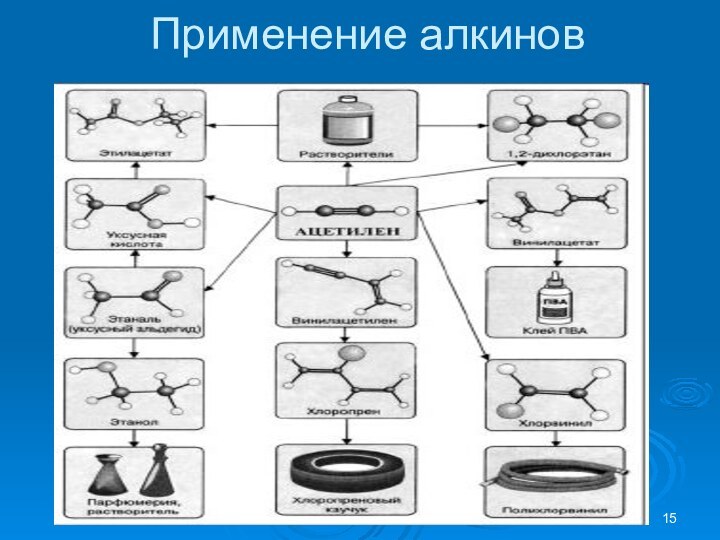
CnH2n-2 – Алкины
CH4 - метан
CH3 – CH3 – этан
CH3 – CH2 – CH3 – пропан
CH3 – CH2 – CH2 – CH3 – бутан…
Углеводороды с общей формулой СnH2n-2, в молекулах которых имеется
одна тройная связь называются алкинами.
нет
- этин
пропин
бутин
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть









нет
- этин
пропин
бутин
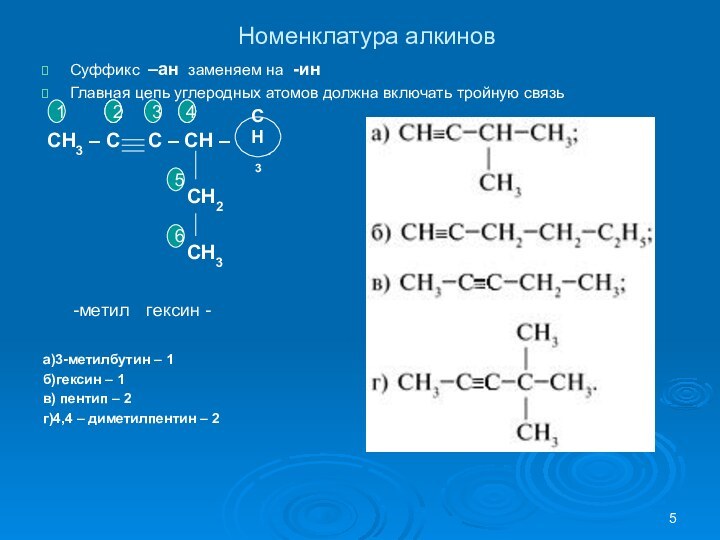
1
2
3
4
5
6
СН3
-метил
гексин -
4
2
2
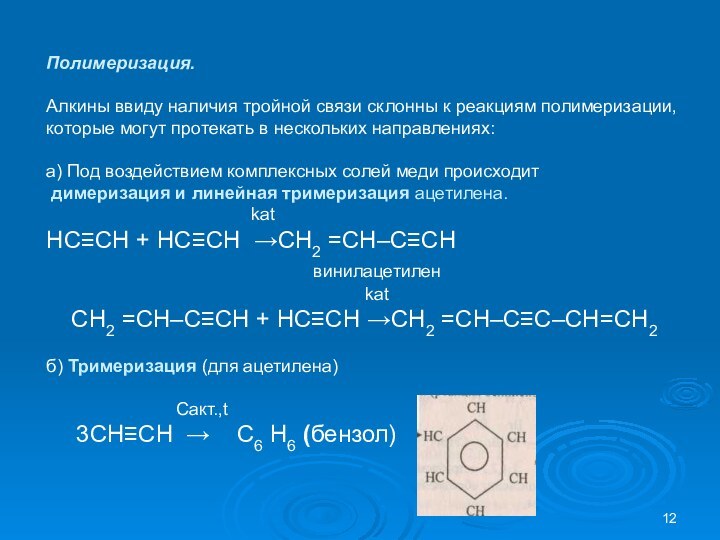
Галогенирование.
Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HC≡C – СН2 – СН3 + Br 2 →
CH3 –C≡CH + CL2 =
Гидрогалогенирование.
Образующиеся продукты определяются правилом Марковникова.
CH3 –C≡CH + HBr →
CH3 –CBr=CH2 + HBr →