- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Уравнения реакций ионного обмена
Содержание
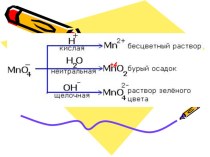
- 2. Реакции ионного обмена-это реакции в водных растворах электролитов между ионами.
- 3. Уравненияреакций ионного обмена называют ионными уравнениями.
- 4. Реакции ионного обмена в растворах электролитов
- 5. Алгоритм составления ионных уравнений1. Напишите уравнение реакции
- 6. Если вещество выпадает в осадокмолекулярное уравнениеNa2SO4
- 7. KBr + AgNO3 = AgBr +KNO3K++
- 8. Если образуется малодиссоциирующее вещество ( например, Н2О
- 9. Реакция взаимодействия сильной кислоты со щелочьюназываетсяреакцией нейтрализации.Это частный случай реакции обмена.
- 10. Реакция обмена между кислотами и нерастворимыми основаниями.Cu(OH)2
- 11. Если выделяется газNa2CO3 + 2HCl = 2NaCl
- 12. Запомни!!! 1. Реакции ионного обмена.2.Молекулярное и ионные уравнения реакций.3.Реакции нейтрализации.
- 13. Спасибо за внимание!
- 18. Скачать презентацию
- 19. Похожие презентации

















Слайд 4 Реакции ионного обмена в растворах электролитов практически необратимо протекают только в
том случае,
если в результате
образуется осадок ( )
образуется малодиссоциирующее
вещество (например, Н2О)выделяется газ( ↑ )
Слайд 5
Алгоритм составления ионных уравнений
1. Напишите уравнение реакции в
молекулярной форме.
2. Определите причину,за счет которой реакция обмена идет
до конца и отметьте это в уравнении реакции соответствующим образом ( или ↑ ). 3. Запишите ионы диссоциирующих веществ, указав их число и заряды.
4. Отметьте одинаковые ионы ( они не принимают участие в реакции ) в левой и правой частях уравнения реакции.
5. Запишите строчкой ниже оставшиеся ионы и вещества.
6.Сформулируйте вывод на основе сокращенного ионного уравнения.
Слайд 6
Если вещество выпадает в осадок
молекулярное уравнение
Na2SO4 +
BaCl2 = BaSO4 + 2NaCl
полное ионное уравнение
2Na++SO42-+Ba2++2Cl- =BaSO4
+ 2Na++2Cl-сокращенное ионное уравнение
Ba2+ + SO42- = BaSO4 Посмотрите опыт
Вывод: реакция ионного обмена протекает до конца, т.к.
образуется осадок
Слайд 8
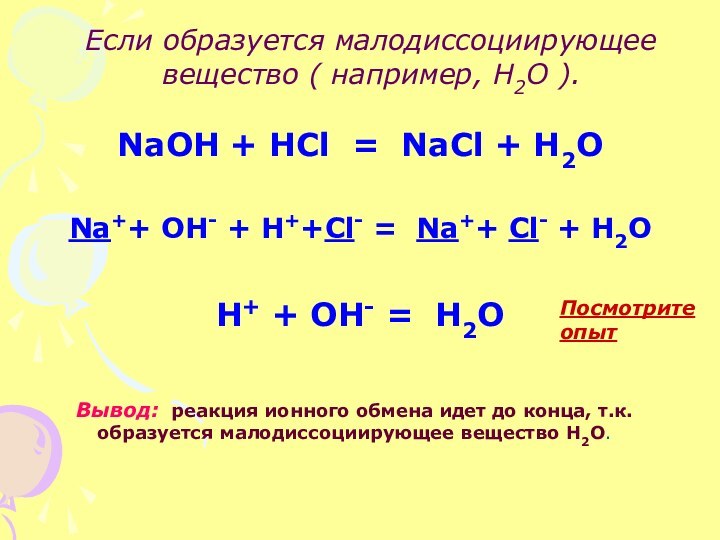
Если образуется малодиссоциирующее вещество ( например, Н2О ).
NaOH
+ HCl = NaCl + H2O
Na++ OH- + H++Cl-
= Na++ Cl- + H2OH+ + OH- = H2O
Вывод: реакция ионного обмена идет до конца, т.к. образуется малодиссоциирующее вещество Н2О.
Посмотрите опыт
Слайд 9
Реакция взаимодействия сильной кислоты со щелочью
называется
реакцией нейтрализации.
Это частный
случай реакции обмена.
Слайд 10
Реакция обмена между кислотами и нерастворимыми основаниями.
Cu(OH)2
+ H2SO4 =
CuSO4 + 2H2O
Cu(OH)2 + 2H++ SO42-=
Cu2++
SO42-+ 2H2OCu(OH)2 + 2H+ = Cu2+ + 2H2O
Вывод: реакция обмена прошла до конца, осадок растворился.
Посмотрите опыт
Слайд 11
Если выделяется газ
Na2CO3 + 2HCl =
2NaCl +
H2O +CO2↑
2Na++ CO32-+ 2H++ 2Cl- = 2Na+ + 2Cl-
+ H2O + CO2↑CO32-+ 2H+ = H2O + CO2↑
Вывод: реакция идет до конца, т.к. выделяется газ.
Посмотрите опыт