Слайд 2
Общая характеристика
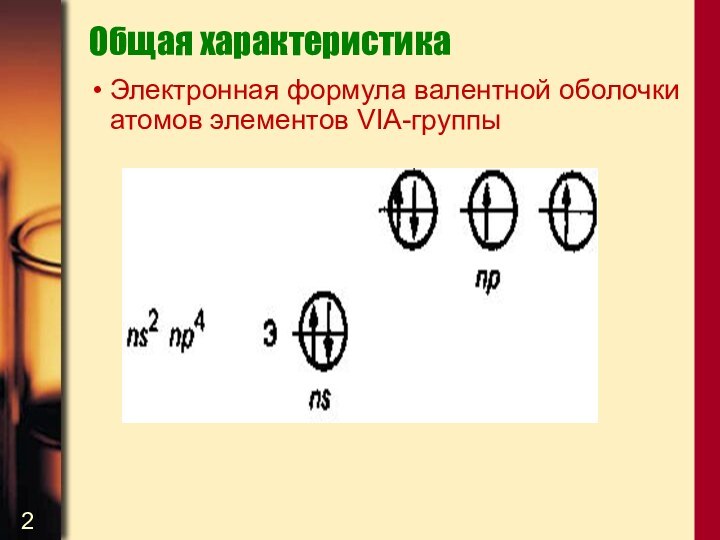
Электронная формула валентной оболочки атомов элементов VIA-группы
Слайд 3
В зависимости от состояния электронной оболочки проявляются разные
степени окисления (СО).
В соединениях с металлами и водородом
элементы этой группы проявляют СО = —2.
В соединениях же с кислородом и неметаллами сера, селен и теллур могут иметь СО = +4 и СО = +6.
В некоторых соединениях они проявляют СО =+2.В
Слайд 4
Кислород (ОЭО = 3,5)
Во фтороксиде F2O СО
кислорода положительна и равна 4-2.
С остальными элементами кислород
проявляет обычно в соединениях степень окисления — 2,
за исключением водородпероксида Н2О2 и его производных, в которых кислород имеет степень окисления —1.
В живых организмах кислород, сера и селен входят в состав биомолекул в степени окисления —2.
Слайд 5
Все это приводит к ослаблению неметаллических свойств халькогенов
при переходе от кислорода к теллуру.
Слайд 6
В нормальных условиях водородные соединения Н2Э элементов VIA-группы,
за исключением воды, — газы с очень неприятным запахом.
Термодинамическая стабильность этих соединений уменьшается от воды к водородтеллуриду Н2Те.
В водных растворах Н2Э проявляют слабокислотные свойства. В H2O — H2S — H2Se — H2Те сила кислот возрастает:
Это объясняется увеличением радиусов ионов Э2- и соответствующим ослаблением связей Э—Н.
В том же направлении растет восстановительная способность Н2Э.
Слайд 7
Сера, селен, теллур образуют два ряда кислотных оксидов:
ЭО2 и ЭО3.
Им соответствуют кислотные гидроксиды состава Н2ЭОз
и Н2ЭО4.
Кислоты Н2ЭО3 в свободном состоянии неустойчивы. Соли этих кислот и сами кислоты проявляют окислительно-восстановительную двойственность, так как элементы S, Se и Те имеют в этих соединениях промежуточную степень окисления + 4.
Кислоты состава Н2ЭО4 более устойчивы и в реакциях ведут себя как окислители (высшая степень окисления элемента +6
Слайд 8
Химические свойства кислорода.
Кислород — самый распространенный элемент
в земной коре (49,4 %)
Элемент кислород существует в виде
двух простых веществ (аллотропные модификации):) О2 и озона Оз.
О3 — имеет более высокие температуры плавления и кипения, обладает резким запахом (отсюда его название).
В О2 имеется тройная связь, а сама молекула представляет собой бирадикал с параллельными спинами неспаренных электронов а следовательно обладает парамагнетизмом.
Под действием света молекулярный кислород переходит в синглетное состояние, т.е. в синглетный кислород О2/, в котором все электроны спарены:
Синглетный кислород неустойчив, период полураспада – 45 минут:
↓↑О:::О +е→О2·¯(супероксидный анион-радикал)
Окислительная способность различных активных форм кислорода возрастает в следующей последовательности: О2<О2/< О2-·¯
Слайд 9
Озон — сильнейший окислитель. Окисляет металлы, бурно реагирует
с органическими веществами, при низкой температуре окисляет соединения, с
которыми кислород не реагирует.
03 + 2Ag = Ag20 + 02
PbS + 4О3 = PbSO4 + 4О2
Широко известна качественная реакция:
2KI + 03 + Н20 = I2 + 2КОН + 02
Окислительное действие озона на органические вещества связано с образованием радикалов.
RH + 03 -+ RO2. + ОН.
радикалы инициируют радикально-цепные реакции с биоорганическими молекулами — липидами, белками, ДНК. Такие реакции приводят к повреждению и гибели клеток.
На этом основано применение озона для стерилизации питьевой воды и воды плавательных бассейнов.
Слайд 10
Кислород – один из самых активных неметаллов.
Он
образует соединения со всеми химическими элементами, кроме гелия, неона
и аргона.
С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины).
Слайд 11
Главная химическая функция кислорода в организме – окисление
веществ, которое сопровождается выделением энергии.
Для клетки очень важно,
чтобы происходила полная утилизация кислорода:
О2+4е+4Н+→2Н2О.
Если процесс восстановления кислорода нарушается, то образуются различные активные формы кислорода, способствующие свободнорадикальному окислению биосубстратов.
Защита от вредного действия активных форм кислорода осуществляется с помощью антиоксидантной системы, в которую входят ферменты супероксиддисмутаза (СОД) и каталаза:
2О2·¯ +2Н+ СОД Н2О2+О2,
2Н2О2 каталаза 2Н2О+О2.
Слайд 12
Сера и ее соединения.
Сера входит в состав белков,
липидов, также в состав некоторых витаминов и биорегуляторов.
Для серы
характерна аллотропия –– ромбической, моноклинической и пластической серы.
Сера способна образовывать устойчивые гомоцепи, которые имеют зигзагообразную форму.
Сера – достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества:
Cu+S→CuS
Zn+S→ZnS
H2+S→H2S.
Довольно легко окисляется кислородом и галогенами:
S+O2→SO2
S+Cl2→SCl2.
Сера растворяется в горячих растворах щелочей и в некоторых кислотах:
3S+6NaOH→2Na2S+Na2SO3+3H2O
S+2H2SO4(конц.)↔3SO2+2H2O
S+6HNO3(конц.)↔H2SO4+6NO2+2H2O.
Слайд 13
Сероводород Очень ядовит, т.к. за счет связывания атомов
меди в цитохромоксидазе блокирует перенос электронов с этого фермента
дыхательной цепи на кислород. и наступает обморочное состояние и даже смерть от паралича дыхания.
Сероводород – бесцветный газ с характерным запахом гниющего белка.
Сероводород – сильный восстановитель. 2KMnSO4+5H2S+3H2SO4→2MnSO4+5S+K2SO4+8H2O,
2H2S+3O2→2SO2+2H2O,
H2S+4Br2+4H2O→H2SO4+8HBr.
H2S образует два типа солей: средние – сульфиды (K2S) и кислые – гидросульфиды (KHS), которые в водных растворах легко гидролизуются:
Na2S+HOH↔NaHS+NaOH,
S2- +HOH↔HS- +OH-.
Слайд 14
Для оксида SO2, кислоты H2SO3 и ее солей
характерна окислительно-восстановительная двойственность:
2SO2(восстановитель)+O2→2SO3
SO2(окислитель)+2H2S→3S+2H2O
H2SO3(восстановитель)+Cl2+H2O→H2SO4+2HCl
2Na2SO3(восстановитель)+O2→2Na2SO4
H2SO3(окислитель)+2H2S→3S+H2O
Na2SO3(окислитель)+S→Na2S2O3.
Однако восстановительные свойства у соединений серы (IV)
преобладают.
При нагревании сульфиты диспропорционируют:
4Na2SO3→3Na2SO4+Na2S.
Слайд 15
Na2S2O3.
– соль тиосерной кислоты H2S2O3. Тиосерная кислота неустойчива
и при получении распадается: Na2S2O3+2HCl→H2S2O3+2NaCl
H2S2O3→H2O+SO2+S.
Тиосульфат-ион образует прочные комплексные соединения
со многими катионами металлов-токсикантов: кадмия, меди (II), ртути (II), свинца (II), серебра. – т.е. он -Антидот при отравлениях
Слайд 16
Диоксид серы может присоединять кислород, переходя в триоксид
серы:
2SO2+O2 ( Pt,t) → 2SO3.
Растворение
его в воде приводит к образованию сильной серной кислоты:
SO3+H2O→H2SO4.
Оксид серы (VI) является типичным кислотным оксидом. Безводная серная кислота – тяжелая, бесцветная, маслянистая жидкость.
Смешивать концентрированную серную кислоту с водой следует осторожно, вливая серную кислоту тонкой струйкой в воду!
Концентрированная серная кислота поглощает пары воды, и поэтому ее применяют в качестве осушителя.
Она отнимает воду и от органических веществ (углеводов и др.), обугливая их:
C12H22O11+H2SO4(конц.)→12C+H2SO4·11H2O.
Слайд 17
В разбавленных растворах серная кислота – окислитель за
счет катионов водорода, которые восстанавливаются до элементарного водорода:
Zn+H2SO4(разб.)→ZnSO4+H2.
Концентрированная серная
кислота является окислителем за счет S+6, окисляя металлы и неметаллы, превращаясь при этом в SO2, S или H2S, в зависимости от условий проведения реакции и свойств веществ:
Cu+2H2SO4 t → CuSO4+SO2+2H2O.
Чем активнее металл, тем сильнее восстанавливается кислота:
3Zn+4H2SO4 t → 3ZnSO4+S+4H2O,
4Mg+5H2SO4 t → 4MgSO4+H2S+4H2O,
C+2H2SO4 t → CO2+2SO2+2H2O,
S+2H2SO4 t → 2SO2+2H2O.
Концентрированная серная кислота окисляет и сложные вещества:
8HJ+H2SO4 t → 4J2+H2S+4H2O,
2HBr+H2SO4 t → Br2+SO2+2H2O.
Слайд 18
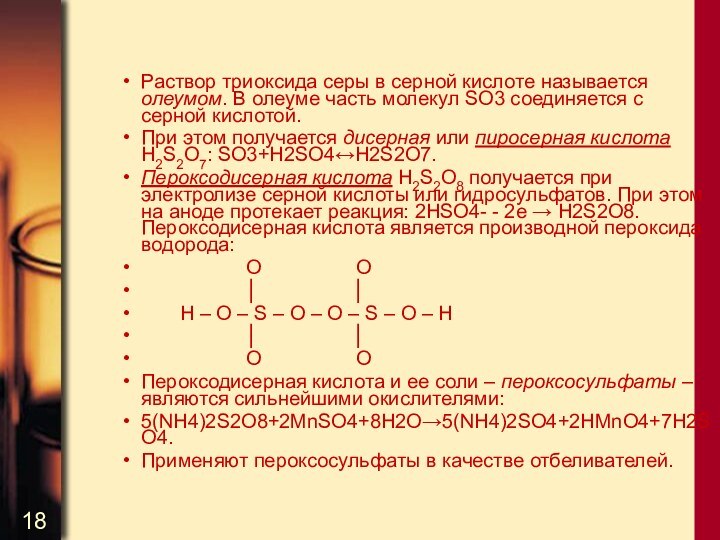
Раствор триоксида серы в серной кислоте называется олеумом.
В олеуме часть молекул SO3 соединяется с серной кислотой.
При этом получается дисерная или пиросерная кислота H2S2O7: SO3+H2SO4↔H2S2O7.
Пероксодисерная кислота H2S2O8 получается при электролизе серной кислоты или гидросульфатов. При этом на аноде протекает реакция: 2HSO4- - 2e → H2S2O8. Пероксодисерная кислота является производной пероксида водорода:
O O
│ │
H – O – S – O – O – S – O – H
│ │
O О
Пероксодисерная кислота и ее соли – пероксосульфаты – являются сильнейшими окислителями:
5(NH4)2S2O8+2MnSO4+8H2O→5(NH4)2SO4+2HMnO4+7H2SO4.
Применяют пероксосульфаты в качестве отбеливателей.
Слайд 19
. Селен и теллур.
По химическим свойствам селен и
теллур похожи на серу.
С водородом они образуют летучие
соединения H2Se и Н2Те.
КАК и сероводород, они в сильной степени обладают восстановительными свойствами. При нагревании они разлагаются.
Прочность молекул в ряду Н2О – H2S – H2Se – H2Te уменьшается. Их соли – селениды и теллуриды.
При сжигании селена и теллура на воздухе образуются оксиды SeO2 и TeO2, являющиеся ангидридами селенистой H2SeO3 и теллуристой H2TeO3 кислот.
Соли селенистой и теллуристой кислот – селениты и теллуриты.
Слайд 20
Соединения Se+4 и Те+4 проявляют преимущественно окислительные свойства,
легко восстанавливаясь до свободных селена и теллура. Например:
SeO2+2SO2+2H2O→2H2SO4+Se↓
H2SeO3+2SO2+H2O→2H2SO4+Se↓.
Сильные окислители
переводят соединения Se+4 и Те+4 в производные этих элементов в степени окисления +6:
5H2SeO3+2KMnO4+3H2SO4→5H2SеO4+2MnSO4+K2SO4+3H2O.
Слайд 21
SeO3 и ТеО3 – кислотные оксиды. Кислородные кислоты
– селеновая H2SeO4 и теллуровая Н2ТеО4 – кристаллические вещества.
Их соли – селенаты и теллураты.
Селеновая кислота принадлежит к сильным кислотам. Она малолетуча, обугливает органические вещества, энергично соединяется с водой.
Селеновая кислота – более сильный окислитель, чем серная.
Теллуровая кислота, в отличии от селеновой и серной, очень слабая кислота. Все соединения селена и теллура ядовиты.
Слайд 22
S -Макроэлемент [0,16%],.
Суточная потребность 4-5 г.
Входит в состав
+++белков, гормонов, витаминов.
+++тиоловых соединений, участвующих
в окислительно-восстановительных реакциях.
+++
Известны три серусодержащих аминокислоты: цистин, цистеин и метионин.
+++ : инсулина, глутатиона, витамина В1, липоевой кислоты
2Н
+++Обратимый переход R1—S—S—R2 ⮀ R1SH + R2SH защищает организм от радиационных поражений.
+++Образование дисульфидных мостиков стабилизирует и определяет третичную структуру белка.
+++Образующаяся в организме Н2SО4 участвует в обезвреживании ядовитых соединений: фенола вырабатываемых в кишечнике из аминокислот микробами.
++++ В соединении с серной кислотой [в виде конъюгатов] выводятся чужеродные вещества.
Слайд 23
++++. Приём серы внутрь способствует рассасыванию нарывов,
+++++ сера
используется как слабительное средство.
+++++В виде мазей и присыпок применяется как
антимикробное средство при лечении кожных заболеваний.
Na2S2O3∙5H2O — тиосульфат натрия — антитоксическое, противовоспалительное средство.
Na2S2O8 — персульфат натрия — антигипоксическое средство.
Na2SO4∙10H2O — сульфат натрия — слабительное.
MgSO4∙7H2O — сульфат магния — понижает артериальное давление.
CaSO4∙2H2O — гипс — используется в хирургической практике.
CuSO4∙5H2O — сульфат меди — при анемии.
FeSO4∙7H2O — сульфат железа — при анемии.
Слайд 25
Кремний
Вакантные орбитали способны к образованию дополнительного πp-d связей
по донорно-акцепторному механизму, если у партнеров есть неподеленные электронные
пары. Это приводит к дополнительному упрочнению связей, например, с О2, F2, Cl2 и т.д.
Si–O по энергии уступает только Si–F (из всех связей для С и Si) и существенно превосходит все остальные
Si–Si – менее прочная, чем С–С
Для всей химии Si характерно высокое сродство к кислороду. Для кремния нехарактерно образование гомоатомных связей
Слайд 26
Кремний
В соответствии с правилом 8-N кристаллизуется в структуре
алмаза
Энергия связей меньше, чем в алмазе, существенно уменьшаются Тпл,
Ткип, ΔЕ.
Алмаз ΔЕ = 5,2 эВ – это диэлектрик
Si ΔЕ = 1,2 эВ, это полупроводник
Расплавленный Si исключительно реакционноспособен – реагирует с графитом, кварцем, металлами, азотом. Не реагирует с Н2
Слайд 27
Элементы подгруппы Ge
Они полные электронные и слоевые
аналоги
2 особенности
Валентной конфигурации ns2np2 предшествует полностью завершенной
(n-1)d-уровень. Сказывается d-сжатие,
особенно заметное у Ge, у него 3d-уровень – кайносимметричный
Существует вакантный nd-уровень, к.ч. = 6, sp3d2, [Э(ОН)6]2–
Слайд 28
Элементы подгруппы Ge
Сверху вниз по группе металличность нарастает,
но немонотонно (Ge близок к Si)
В этом же направлении
увеличивается стабильность степени окисления +2
Sn - промежуточное положение (+2 или +4), но ближе к Ge
Pb – эффект 6s2 инертной электронной пары
Слайд 29
Простые вещества
Ge - структура типа алмаза, известны и
фазы высокого давления
Sn – тетрагональная решетка, но она близка
к ГЦК, только слегка вытянута по оси С. Ниже +13 ºС т/д стабильна α-модификация со структурой типа алмаза и полупроводниковыми свойствами. Кинетически этот переход заторможен
Pb – ГЦК решетка, не подчиняются правилу Юм-Розери
В ряду стандартных электродных потенциалов Ge – после водорода, Sn и Pb – непосредственно перед
Слайд 30
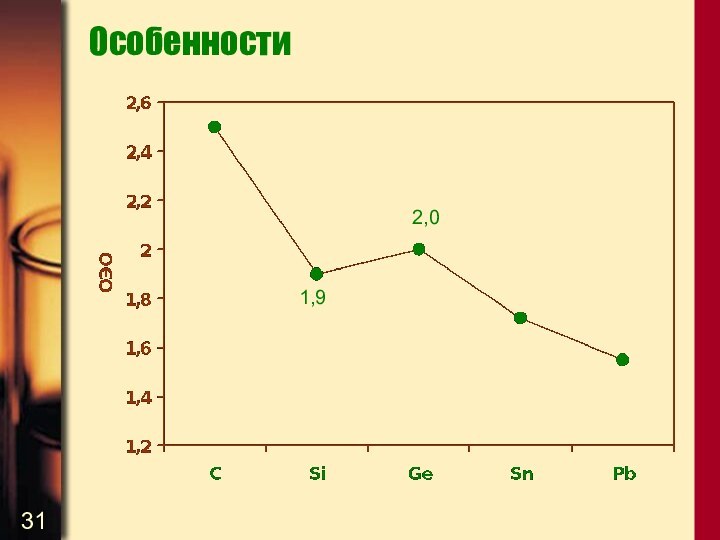
Особенности
Итак, атомные радиусы в ряду
C – Si –
Ge – Sn – Pb увеличиваются
Неравномерность их увеличения при
переходе от Si к Ge и от Sn к Pb обусловлена влиянием внутренних (3d и 4f) электронных оболочек, электроны которых слабо экранируют заряд ядер атомов. Это приводит к сжатию е- оболочек Ge и Pb из-за повышения эффективного заряда ядра
От С к Pb энергии ионизации элементов в целом понижаются, что приводит к усилению их металлических свойств, т.е. к росту основности катионов
Слайд 32
Особенности
В химических соединениях элементы IVA группы проявляют степени
окисления –4, 0, +2, +4
Устойчивость соединений с высшей степенью
окисления максимальна для Si и постепенно понижается в ряду Ge – Sn – Pb
Устойчивость степени окисления +2 в этом ряду возрастает. Поэтому неорганические соединения Pb(IV) сильные окислители, а соединения Si не проявляют окислительных свойств. Соединения же Si(II) Ge(II) и Sn(II) – сильные восстановители, для Pb(II) восстановительные свойства нехарактерны
Слайд 33
Особенности
При движении сверху вниз по группе происходит последовательный
переход от неметаллов к металлам, окислительные свойства соединений с
высшей степенью окисления усиливаются
Восстановительные свойства соединений с низкой степенью окисления ослабляются
Слайд 34
Нахождение в природе и получение
Содержание: С (0,048
%) в живых организмах: в организме человека массой 70
кг содержится 16 кг С, т.е. 22,9 мас. % в древесине содержание С достигает 40 %
Слайд 35
Нахождение в природе и получение
Si самый распространенный после
О элемент: 25,7 масc. %
Слайд 36
Нахождение в природе и получение
Ge и Sn (2,1·10–4
и 1,5·10-4 %) соответственно
Pb (1,3·10–4 масс. %)
Sn
Pb
Слайд 37
Получение
Кремний
SiCl4 + 2Zn (tºC) → Si
+ 2ZnCl2
а так же при термическом разложении SiН4
Или особочистый:
SiCl4
+ 2Н2 → Si + НCl
Германий
GeO2 + 4HCl (tºC) → GeCl4 + 2H2O
GeO2 + 2H2 = Ge + 2H2O
Слайд 38
Получение
Олово
SnO2 + 2C (tºC) = Sn + 2CO↑
Свинец
– обжиг галенита
2PbS + 3O2 (tºC) = 2PbO +
2SO2↑
PbO + C (tºC) = Pb + CO
Полученный металл очищают электролитическим рафинированием
Слайд 39
Химические свойства
Углерод взаимодействует из галогенов лишь с
F2, не вступает в реакцию с N2 и Р
– низкая реакционная способность
Наиболее инертен алмаз, в атмосфере О2 при температуре выше 730˚С сгорает с образованием CО2, инертен по отношению к щелочам и кислотам
Графит – с О2 и F2 при более низких t˚, и также:
C + 4HNO3(конц) = CO2↑ + 4NO2↑ + 2H2O
(с серной также)
H2O(пар) + C(раскал) = H2 + CO
(водяной газ)
Слайд 40
Химические свойства
Аморфный уголь – восстановитель:
ZnO + C (tºC)
= Zn + CO↑
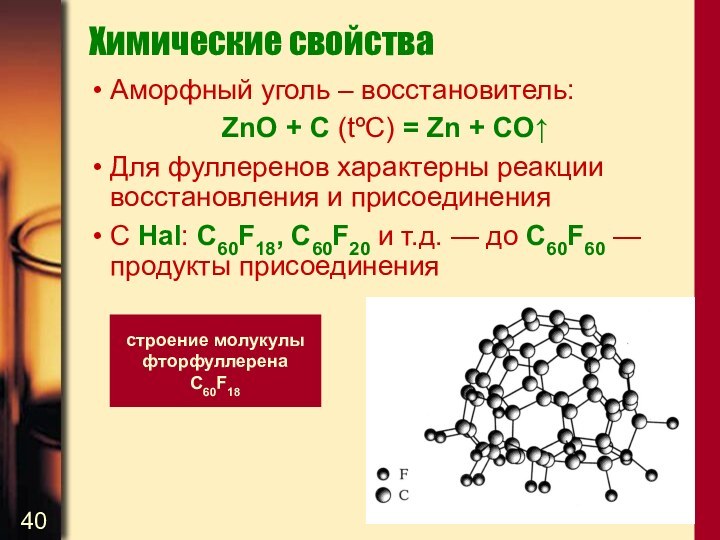
Для фуллеренов характерны реакции восстановления и
присоединения
C Hal: C60F18, C60F20 и т.д. — до C60F60 — продукты присоединения
строение молукулы фторфуллерена С60F18
Слайд 41
Химические свойства
Реакционная способность простых веществ в ряду Si
– Ge – Sn – Pb возрастает по мере
уменьшения энергии связи между атомами
При нагревании они взаимодействуют с большинством неметаллов
Ge и Sn образуют соединения в высшей степени окисления: ЭО2, а свинец обычно окисляется до +2
Расплавленный свинец окисляется на воздухе до PbO, а при 500ºС в избытке кислорода — до Pb3O4
Слайд 42
Химические свойства
В ряду стандартных электродных потенциалов – Sn
и Pb до водорода, Ge – после, поэтому с
кислотами-неокислителями реагируют лишь Sn и Pb. Si в кислой среде пассивируется, Si и Ge растворяются в смеси кислот:
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O
3Ge + 4HNO3 + 18HCl = 3H2[GeCl6] + 4NO + 8H2O
Sn + 2HCl = SnCl2 + H2
Sn + 4HNO3(конц) = SnO2·xH2O↓ + 4NO2↑ + (2-x)H2O
3Pb + 8HNO3(разб) = 3Pb(NO3)2 + 2NO↑ + 4H2O
β-олов.кислота
Слайд 43
Химические свойства
С HCl — при нагревании, PbCl2 малорастворим.
В H2SO4 и концентрированной HNO3 пассивируется
Мелкодисперсный кремний растворяется в
щелочах
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Ge + 2KOH + 2H2O2 = K2GeO3 + 3H2O – в присутствии окислителей
Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2↑
Pb не реагирует со щелочами
горячий раствор
Слайд 44
Водородные соединения
Углеводороды — в курсе органической химии
CH4
– карбид водорода:
ОЭО (C = 2,6, Н = 2,1)
Но
у других проблемы:
ОЭО Si = 1,9; Ge = 2,0
СН4 при обычных условиях устойчив
Получение:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Слайд 45
Водородные соединения
Водородные соединения Si, Ge, Sn, Pb –
силаны, германы, станнаны, плюмбаны
Силаны и германы ЭnH2n+2 (Э =
Si,Ge) напоминают гомологический ряд углеводородов
Энергия связей Э–Э и Э–Н в ряду
С – Si – Ge – Sn – Pb понижается, поэтому уменьшается количество водородных соединений: Si – 14, Ge – 9, Sn – 2, Pb – 1, понижается их устойчивость
Mg2Si + 4HCl → 2MgCl2 + SiH4
SiCl4 + Li[AlH4] = SiH4↑ + LiCl + AlCl3
то же — для Ge, Sn, Pb
смесь силанов
Слайд 46
Водородные соединения
ЭН4 — тетраэдры
В ряду СН4 – SiH4
– GeH4 – SnH4 возрастают Tпл. и Tкип. (рост
межмолекулярного взаимодействия)
С ростом R атома энергия связи Э – Н постепенно убывает, падает термическая устойчивость
PbH4 практически не охарактеризован
С несет частичный заряд –δ (Н в ряду напряжения — между С и остальными элементами IVА группы), у остальных — +δ
Слайд 47
Водородные соединения
Возрастание атомного радиуса сверху вниз создает возможность
повышения к.ч. и образования промежуточных соединений
Реакционная способность существенно выше,
чем у алканов
Центральный атом в силане, германе и станнане необычайно чувствителен к нуклеофильной атаке
Слайд 48
Водородные соединения
Хлорирование SiH4 и SnH4 интенсивно протекает и
в темноте, метана – на свету
SiH4 + HCl =
SiH3Cl + H2
СН4 устойчив к гидролизу, а SiH4 и GeH4 взаим. (ускорение гидролиза щелочами)
SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2
Силан, герман, станнан – сильные восстановители
SiH4 + 2AgCl = SiH3Cl + HCl + 2Ag
При замещении Н на металл — карбиды, силициды, германиды, станниды и плюмбиды
SiH4 + 2H2O → SiO2 + 4H2
SiH4 + 4F2 → SiF4 + 4HF (со взрывом)
Слайд 49
Кислородные соединения
Элементы IVА группы проявляют степени окисления
+2 и +4
CO и СО2, неустойчивый С3О2
(O = C
= C = C = O) (дегидратация малоновой кислоты), С5О2
Получен эпоксид фуллерена С60О
Слайд 50
СО – тройная связь, третья по донорно-акцепторному механизму
C
O
Изоэлектронна
N2 но ее энергия связи выше
Кислородные соединения - CO
s
p
2
2
Слайд 51
Кислородные соединения - CO
Молекула СО диамагнитна. Сочетает свойства
донора и акцептора (наличие е- пары на связывающей 3σ
молекулярной орбитали и 2 вакантные 2π-орбитали)
Карбонилы
Ni + 4CO → Ni(CO)4
Fe3O4 + CO → Fe + CO2
Восстановитель!
Слайд 52
Кислородные соединения - CO
Это несолеобразующий оксид, формиаты образуются
при 100–130ºС, р = 5атм с расплавленными щелочами:
СО +
NaOH = HCOONa
Обладает восстановительными свойствами:
CO + PdCl2 + H2O → Pd↓ + 2HCl + CO2
2[Ag(NH3)2]OH + CO = 2Ag↓ + (NH4)2CO3 + 2NH3
В присутствии катализатора – разрыв тройной связи:
CO + Cl2 = COCl2
фосген
(дихлорид карбонила)
катализатор
– активированный уголь
Слайд 53
Кислородные соединения – CO2
O = C = O
- линейная молекула
2σ – связи С – О образованы
sp-гибридизированной орбиталью атома С и 2Рz-орбиталями атомов кислорода. Не участвующие в sp-гибридизации 2Рx- и 2Рy-орбитали С перекрываются с аналогичными орбиталями атомов О. При этом образуются две π–орбитали расположенные во взаимно перпендикулярных областях
Слайд 54
Кислородные соединения – CO2
Молекула неполярная => мало растворим
в H2O
Химически инертен, высокая энергия связи
С сильными восстановителями –
проявляет окислительные свойства при высоких T:
C + CO2 (1000ºC) 2CO
CO2 + 2Mg = 2MgO + C
зажженный на воздухе Mg продолжает гореть и в углекислом газе
уголь
Слайд 55
Кислородные соединения – CO2
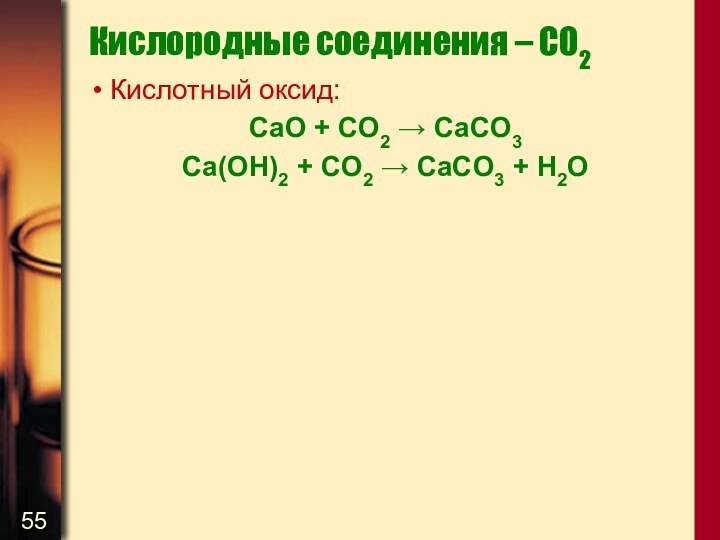
Кислотный оксид:
CaO + CO2 →
CaCO3
Ca(OH)2 + CO2 → CaCO3 + H2O
Слайд 56
Кислородные соединения – H2CO3
H2CO3 – слабая и неустойчивая
кислота, в свободном виде из водных растворов выделить нельзя.
В отсутствие H2O относительно устойчива
Соли – карбонаты
Устойчивы только карбонаты щелочных металлов, они плавятся без разложения
MeCO3 = MeO + CO2
Слайд 57
Кислородные соединения – H2CO3
СО32– – правильный треугольник
sp2
– гибридизации (3 гибридные орбитали атома С участвуют в
образовании σ-ковалентные связи с тремя атомами кислорода). Оставшаяся р-орбиталь, перпендикулярная плоскости треугольника, перекрывается с аналогичной орбиталью каждого атома кислорода, что приводит к образованию нелокализованной системы π-связей. В результате кратность связи повышается до 1,33
C
O
120°
O
O
2–
Слайд 58
Кислородосодержащие кислоты и соли
Na2CO3 + 2HCl = 2NaCl
+ H2O + CO2
KID = 4·10–7, KIID = 5·10–11
Все
карбонаты гидролизируются по аниону
КГ = КW/KD
СО32– + НОН НСО3– + ОН–
МеIIСO3 = МеО + СО2
СаСО3 – 800 °C, ZnCO3 – 200 °C
K2CS3 + 2HCl = 2KCl + H2CS3
KID = 10–3
измеряя рН
Слайд 59
Кислородосодержащие кислоты и соли
Пероксомоноугольная H2CO4
Пероксодиугольная H2C2O6
O = C
O
– H
O – O – H
C – O –
O – C
O
OH
O
HO
Неизвестны в свободном состоянии
Слайд 60
Кислородосодержащие кислоты и соли
Na2C2O6 + 2H2O = 2NaHCO3
+ H2O2
Na2C2O6 + H2SO4 = Na2SO4 + CO2 +
H2O2
Получают пероксокарбонаты анодным окислением карбонатов
А: 2CO32– – 2ē = С2О62–
Они сильные окислители:
К2С2О6 + 2KI = 2K2CO3 + I2
Для пероксомоноугольной:
Na2O2 + СО2 = Na2CO4
NaOOH + CO2 = NaHCO4
Слайд 61
Кислородные соединения – H2CO3
Донорные свойства СО32– – в
реакциях образования комплексов с переходными металлами, когда химическая связь
– за счет вакантных d-орбиталей Ме и р-электронов карбонат-иона:
Cu2(OH)2CO3 + 3Na2CO3 =
2Na2[Cu(CO3)2] + 2NaOH
Слайд 62
Кислородные соединения Si
От С к Si уменьшается прочность
кратной связи Э – О и увеличивается прочность одинарной
σ-связи. Рост ионной составляющей химической связи – кроме этого
SiO
SiO2 + Si (1300°С) → SiO
пары
монооксида
Слайд 63
Кислородные соединения Si
SiO2 – при обычных температурах и
давлениях – кварц, тридимит, кристобалит
Все построены из тетраэдров SiO4,
соединенных с соседними тетраэдрами всеми 4 атомами кислорода в трехмерные решетки
Взаимное расположение в кристаллических модификациях различное
α- и β-формы отличаются углами поворота тетраэдров относительно друг друга и небольшим смещением атомов
Слайд 65
Кислородные соединения Si
Взаимные переходы между различными модификациями SiO2
требуют разрыва связи Si – O – Si и
их перестройки по другому пространственному мотиву и протекают медленно даже при высоких t°
SiO2 + 2Mg (tºC) → Si + 2MgO (> 1000ºC)
SiO2 + 2H2 (tºC) → Si + 2H2O
Избыток восстановителя:
Si + 2Mg (tºC) → Mg2Si
Газообразный F2:
SiO2 + 2F2 → SiF4(г) + O2
SiO2 + 4HCl → SiCl4(г) + H2O
Слайд 66
Кислородные соединения Si
SiO2 проявляет кислотные свойства с растворами
и расплавами щелочей, основными оксидами и карбонатами:
SiO2 + CaO
(tºC) → CaSiO3
Все формы SiO2 устойчивы к воздействию кислот, но растворяются (кроме стишовита) в HF:
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
SiO2 – ангидрид кремниевых кислот
Слайд 67
Кислородные соединения Si
H4SiO4 – не выделена, т.к. при
концентрировании претерпевает поликонденсацию. Слабая кислота
Na2SiO3 + 2HCl → H2SiO3↓
+ 2NaCl
Na2SiO3 + CO2 + 2H2O → H2SiO3↓ + Na2CO3
В растворах: SiO2·2H2O - орто-, H2SiO3 (SiO2·2H2O) - мета, есть и другие
Слайд 68
Кислородные соединения Si
В H2O растворимы только силикаты щелочных
металлов и аммония, в растворе гидролизируются, формально:
Na2SiO3 +
H2O NaOH + H2SiO3
фактически смесь полисиликатов, при подкислении образуются золи. При нагревании или старении переходят в гели поликремниевых кислот переменного состава
Метасиликат Na:
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
(сплавление с содой)
Слайд 69
Кислородные соединения Ge, Sn, Pb
Сверху вниз с увеличением
размера Э+4 их к.ч. в ряду диоксидов и других
кислородных соединений возрастают от 4 до 6, понижается прочность связи Э – О, ослабевают кислотные и усиливаются основные свойства
SiO2 и СO2 – кислотные, GeO2, SnO2 и PbO2 – амфотерные, для PbO2 преобладают основные свойства
PbO2 – сильный окислитель, единственный из диоксидов IV группы не может быть получен при окислении Pb кислородом
Слайд 70
Кислородные соединения Ge, Sn, Pb
GeO2 – окисление Ge
+ O2 или обезвоживание гидратов. Много аналогий с SiO2.
Амфотерен с преобладанием кислотных свойств. Но существуют соли Ge(SO4)2, Ge(ClO4)4, не имеющие аналогов в химии Si – более выраженный металлический характер
SnO2 – структура типа рутила, амфотерен с преобладанием основных свойств, не растворим в H2O и разбавленных растворах кислот и щелочей
SnO2 + 2NaOH(расплав) (tºC) = Na2SnO3 + H2O
При обработке водой станната Na – Na2[Sn(OH)6]
Слайд 71
Кислородные соединения Ge, Sn, Pb
Диоксиды GeO2, SnO2 обладают
слабыми окислительными свойствами
ЭO2 + 2C (tºC) = Э
+ 2CO↑
PbO2 – электролиз или окисление растворимых солей Pb(II) сильными окислителями
Pb(CH3COO)2 + CaOCl2 + H2O =
PbO2↓ + 2CH3COOH + CaCl2
Слайд 72
Кислородные соединения Ge, Sn, Pb
В H2O, разбавленных кислотах
HCl, HNO3, H2SO4 и щелочах не растворяются. С концентрированными
кислотами – сильный окислитель:
PbO2 + 4HCl = PbCl2↓ + Сl2↑ + 2H2O
Способен окислять воду до кислорода. С концентрированными растворами щелочей может образовывать [Pb(OH)6]2– гексагидроксоплюмбат-ионы
Слайд 73
Кислородные соединения Ge, Sn, Pb
Еще известны смешанные оксиды
Sn3O4, Pb3O4
3PbO2 (300-500 °С) = Pb3O4 + O2
В нем
присутствуют Pb+2 и Pb+4, это можно доказать
Pb3O4 + 8CH3COOH(ледяная) =
Pb(CH3COO)4 + 4H2O + 2Pb(CH3COO)2
Слайд 74
Кислородные соединения Ge, Sn, Pb
Состав высших гидрооксидов не
соответствует H2ЭO3 или Э(OH)4. Это ЭО2∙xH2O
Свойства определяются количеством присоединенной
H2O
Для Ge и Sn амфотерны, образуют анионные: Me2+1Э+4O3, Me2+1[Э+4(OH)6] и катионные Э+4(SO4)2, Э+4(CH3COO)4 формы
Анионные: Na2GeO3, K4GeO4 – германаты, Na2SnO3, Ca2PbO4 – cтаннаты и плюмбаты
Катионные: Sn(SO4)2, Sn(NO3)4, Pb(CH3COO)4
Слайд 75
Кислородные соединения Ge, Sn, Pb
Получают сплавлением
Na2CO3 + GeO2
= Na2GeO3 + CO2↑
2CaO + PbO2 = Ca2PbO4
Ca2PbO4 +
4HNO3 = PbO2↓ + 2Ca(NO3)2 + 2H2O
Слайд 76
Кислородные соединения Ge, Sn, Pb
При гидролизе SnCl4 в
присутствии NH3 образуется гидрат SnO2∙nH2O. Свежеполученный осадок (α-оловянная кислота)
раст-ся в кислотах и щелочах
После стояния или слабого нагрева – образуется β-оловянная кислота, растворимая только в расплавленных щелочах. Пониженная реакционная способность β-кислоты объясняется процессами поликонденсации, уменьшением числа активных OH-групп и образованием прочных связей Sn – O – Sn
Слайд 77
Соединения Э(II)
Все элементы в степени окисления +2 обладают
неподеленной электронной парой, которая обуславливает их стереохимию и донорные
свойства
Э(II) являются восстановителями, от Si к Pb восстановительная способность убывает. Растет термическая устойчивость и основные свойства
Слайд 78
Оксиды (II)
GeO2 + Ge = 2GeO
Склонен к диспропорционированию,
на воздухе медленно окисляется до GeO2
Sn(II) и Pb(II) –
термическое разложение солей или гидратированных оксидов (II) без воздуха
Pb(NO3)2 (t °C) = PbO + 2NO2 + O2
SnC2H4 (t °C) = SnO + CO + CO2
2SnO (t °C) = SnO2 + Sn
Слайд 79
Оксиды (II)
SnO имеет несколько кристаллических модификаций. Это типичное
амфотерное соединение. В к-тах – соли и комплексы Sn(II),
в щелочах – [Sn(OH)3]–
Гидроксостаннаты (II) диспропорционируют
2Na[Sn(OH)3] (t °C) = Sn + Na2[Sn(OH)6]
поэтому при растворении Ме горячей щелочи образуются производные (IV)
Sn + 2NaOH + 4H2O = Na2[Sn(OH)6] + 2H2
Слайд 80
Оксиды (II)
Для PbO – кристаллические формы: красная тетрагональная
(глет) и желтая ромбическая (массикот)
PbO + 2HNO3 = Pb(NO3)2
+ 2H2O
Проявляет основные свойства, однако, в концентрированных растворах щелочей растворяется – [Pb(OH)6]4–
Водные растворы солей Pb более устойчивы к гидролизу и окислению, чем растворы аналогичных солей Sn(II)
Слайд 81
Оксиды (II)
Восстановительные свойства соединений слабеют в рядах Ge(II)
– Sn(II) – Pb(II)
Ge(II) и Sn(II) в растворах –
сильные восстановители
3Na[Sn(OH)3] + 2Bi(NO3)3 + 9NaOH =
2Bi + 3Na2[Sn(OH)6] + 6NaNO3
Соединения Pb(II) – только в присутствии сильных окислителей проявляют восстановительные свойства:
2Pb(CH3COO)2 + Ca(OCl)2 + 4NaOH =
2PbO2↓ + 2CaCl2 + 4CH3COONa + 2H2O
Слайд 82
Галогениды
Типа СHal4 – для всех галогенов, неполярные соединения,
тетраэдрические молекулы
ССl4 – не смешивается с водой и не
реагирует с ней при обычных условиях – валентная и координационная ненасыщенность
CS2 + 3Cl2 = CCl4 + S2Cl2
Al2O3 + 3CCl4 (t °C) = 2AlCl3 + 3COCl2
Si + 2Hal2 = SiHal4
SiHal4 – координационное ненасыщенные, поэтому гидролизируются (кроме SiF4) с выделением SiO2∙nH2O
Слайд 83
Галогениды
SiF4 + (n+2)H2O = H2SiF6 + SiO2∙nH2O↓ +
2HF
Частично гидролизируется, а частично реагирует с выделением HF
Si +
3HCl (350 °C) = SiHCl3 + H2O
SiHCl3 + 2H2O = SiO2 + 3HCl + H2↑
При взаимдействии с Hal – GeHal4, SnHal4, но PbHal2
ЭHal2 – для Ge и Sn. PbHal2 (кроме PbBr4 и PbI4)
PbO2 + 4HCl = PbCl4 + 2H2O
PbCl4 = PbCl2 + Cl2
сил. восстановитель
Слайд 84
Галогениды
Дигалогениды диспропорционируют
2GеHal2 Ge + GeHal4
SnCl2 – не
диспропорционирует, но является сильным восстановителем
2BiCl3 + 3SnCl2 = 2Bi
+ 3SnCl4
Дигалогениды Pb – типичные соли
t1
t2
Слайд 85
Галогениды
Изменение стабильности 2-х степеней окисления:
Si – диспропорционируют и
SiO, и SiHal2
Ge – GeO не диспропорционирует, а GeHal2
диспропорционирует
Sn – SnO и SnHal2 не диспропорционируют, но восстановители
Pb – PbO и PbHal2 устойчивы
Слайд 86
Галогениды
Э+4 – основные свойства выражены слабо, ЭHal4 склонны
к глубокому гидролизу
ЭHal4 + 6H2O = 4HF + H2[Э(OH)6]
Их
только формально можно рассматривать как соли слабого основания и сильной кислоты, а вообще, они координационно ненасыщенны, льюисовы кислоты, склонны к комплексообразованию
2НHal + ЭHal2 = H2[ЭHal6]
Для Ge – фторокомплексы, Sn и Pb со всеми Hal, в том числе и H2[PbI6]
Слайд 87
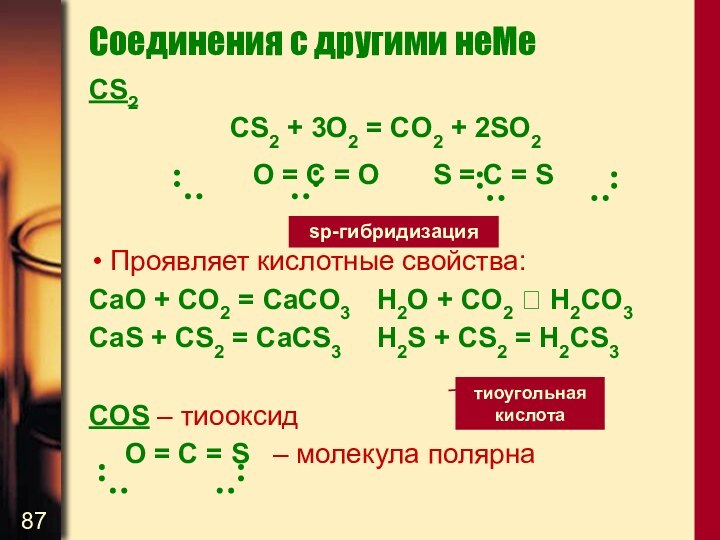
Соединения с другими неМе
CS2
CS2 + 3O2 = CO2
+ 2SO2
О = С = О S = C =
S
Проявляет кислотные свойства:
СaO + CO2 = CaCO3 H2O + CO2 H2CO3
CaS + CS2 = CaCS3 H2S + CS2 = H2CS3
COS – тиооксид
О = С = S – молекула полярна
sp-гибридизация
тиоугольная
кислота
Слайд 88
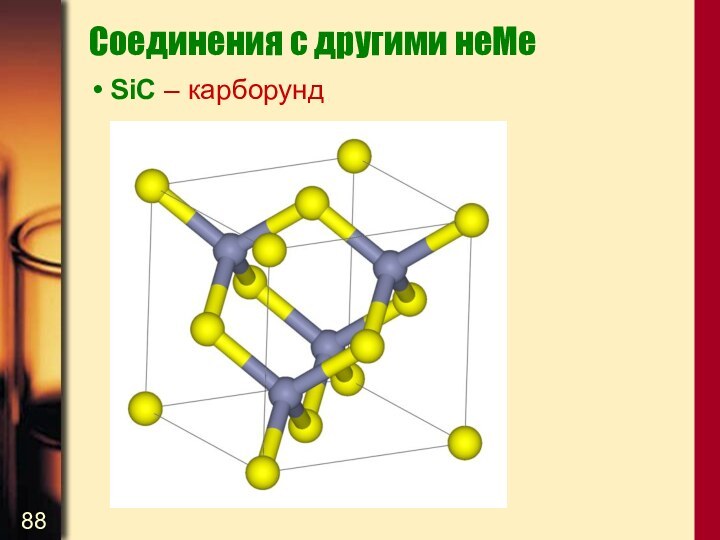
Соединения с другими неМе
SiC – карборунд
Слайд 89
Соединения с азотом
электрическая дуга – (CN)2
Здесь нечетное число
вал. электронов
•C ≡ N мономер (СN)2 дициан
Делокализованные π-связи между
атомами в линейной молекуле
N = C – C = N
По хим. свойствам напоминают Hal2
Hal2 + Н2О НF + HOHal
(СN)2 + H2O HCN + HOCN
циановая
циановодородная
Слайд 90
Соединения с азотом
Существуют смешанные галогенцианы
ClCN + 2NaOH
NaCl + NaCNO + H2O
H – C ≡ N
H – N C
Таутомерия (динамическое равновесие между всеми изомерами)
HCN ← CN– → HNC
H+
Слайд 91
Соединения с азотом
CN– – изоэлектронен N2 (прочность, донорная
активность)
2CH4 + 2NH3 + 3O2 (Pt) → 2HCN +
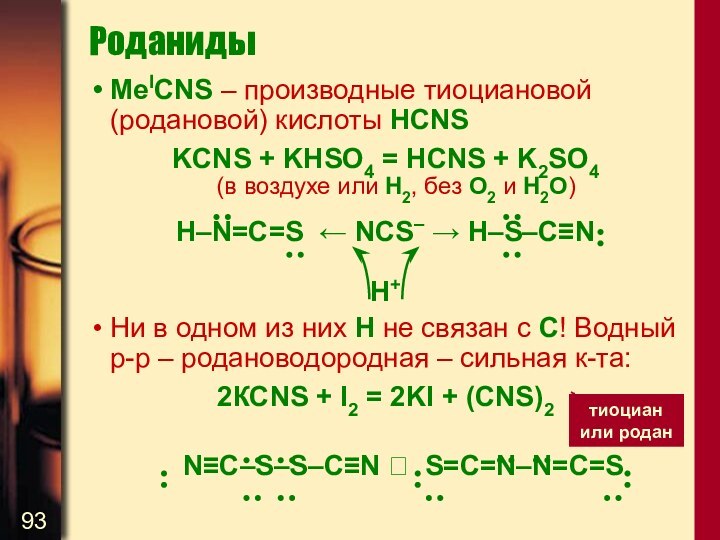
6H2O
CO + NH3 → H2O + HCN
Формальная степень окисления C+2, легко окисляется:
2КСN + O2 = 2KCNO
KCN + S = KCNS
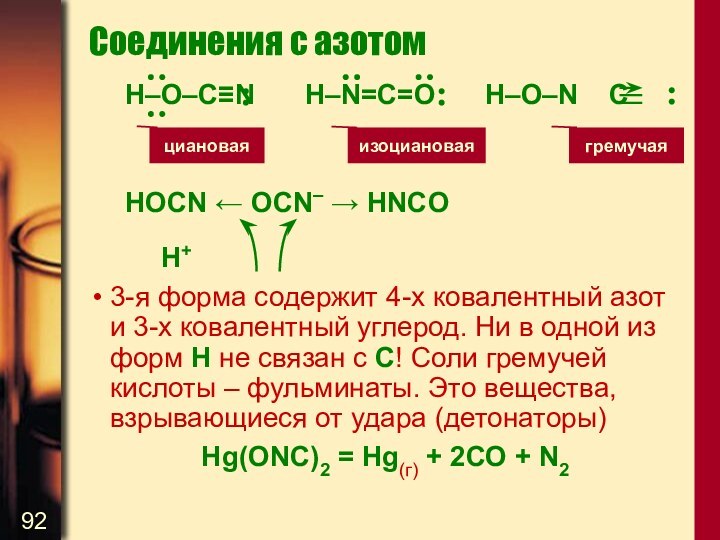
Слайд 92
Соединения с азотом
H–O–C≡N H–N=C=O H–O–N C
HOCN ← OCN– →
HNCO
H+
3-я форма содержит 4-х ковалентный азот и 3-х ковалентный
углерод. Ни в одной из форм Н не связан с С! Соли гремучей кислоты – фульминаты. Это вещества, взрывающиеся от удара (детонаторы)
Нg(ONC)2 = Hg(г) + 2СО + N2
циановая
изоциановая
гремучая



















![VI группа периодической системы. VIA-группа S -Макроэлемент [0,16%],.Суточная потребность 4-5 г. Входит в состав +++белков, гормонов, витаминов. +++тиоловых](/img/tmb/15/1443303/edf3a3a6e9e918cdeb89d1c4a9755dd0-720x.jpg)