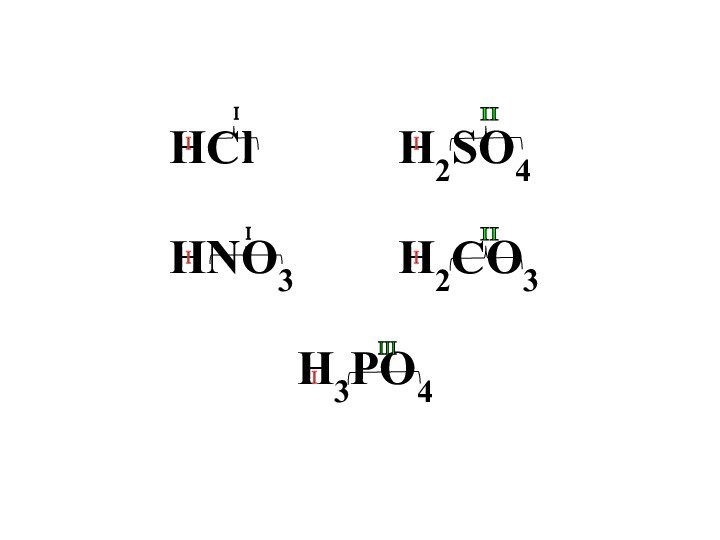
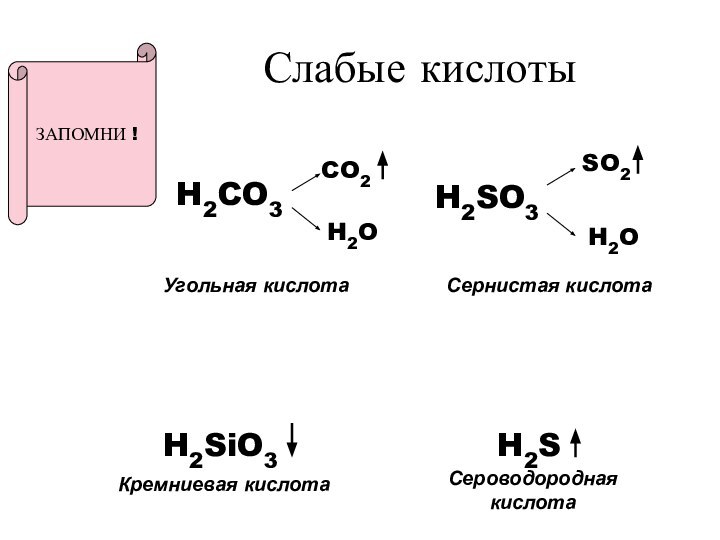
H2CO3
H3PO4I
I
I
I
I
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

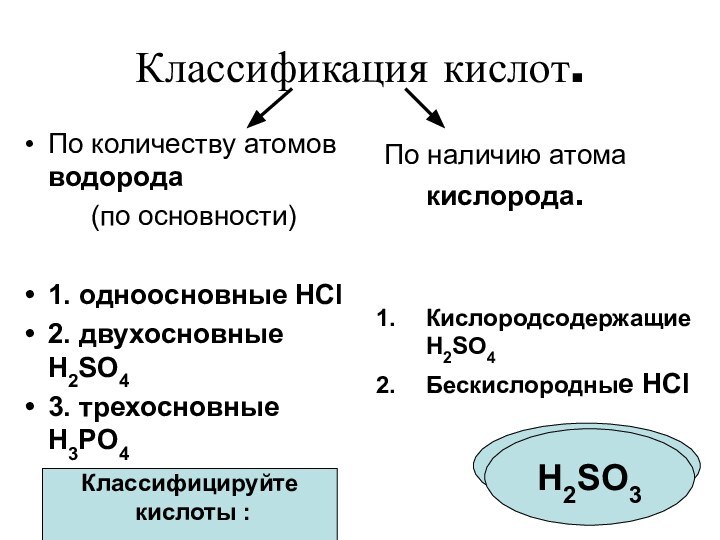





Классифицируйте
кислоты :
HF
H2SO3
вытесняют водород из кислот
водород из кислот
не вытесняют
Mg
Zn
Сu
Ме0
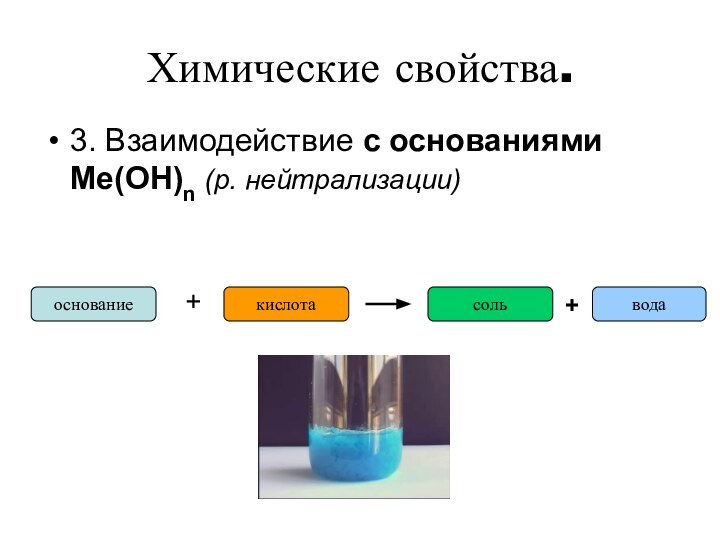
+
кислота
соль
Н2
+
до водорода
Кроме HNO3
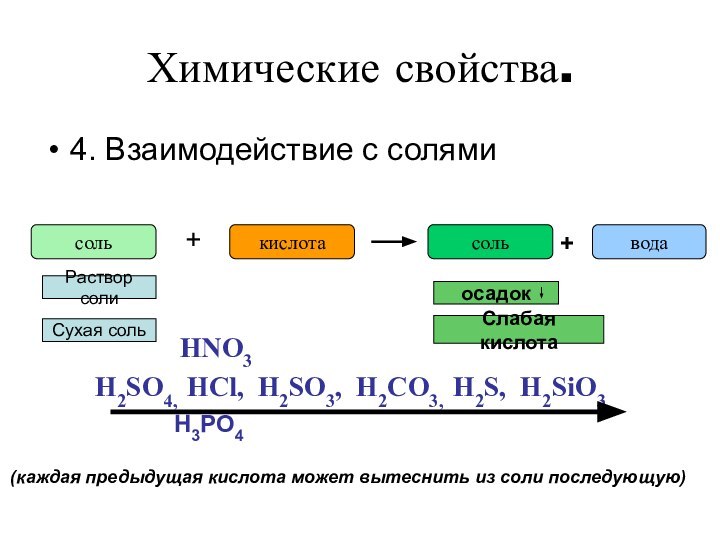
осадок
Сухая соль
Слабая кислота
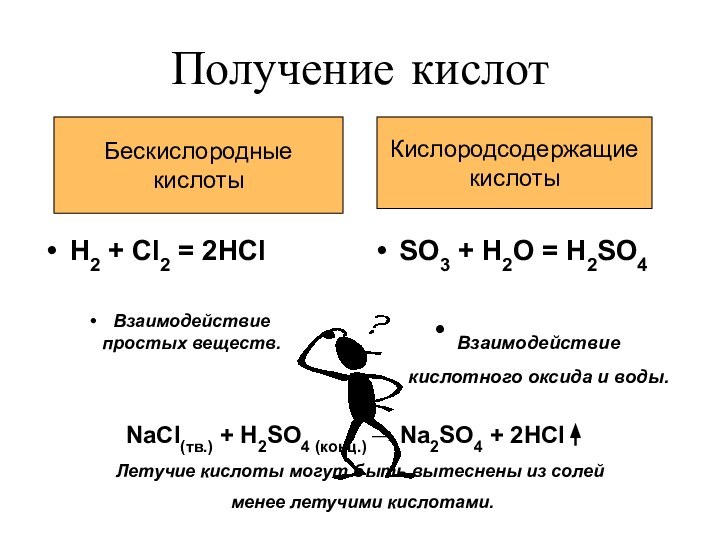
NaCl(тв.) + H2SO4 (конц.) → Na2SO4 + 2HCl
Летучие кислоты могут быть вытеснены из солей
менее летучими кислотами.