Слайд 2
1. Электролитом является:
1)формальдегид;
2)метанол;
3)ацетат калия;
4)глицерин.
Слайд 3
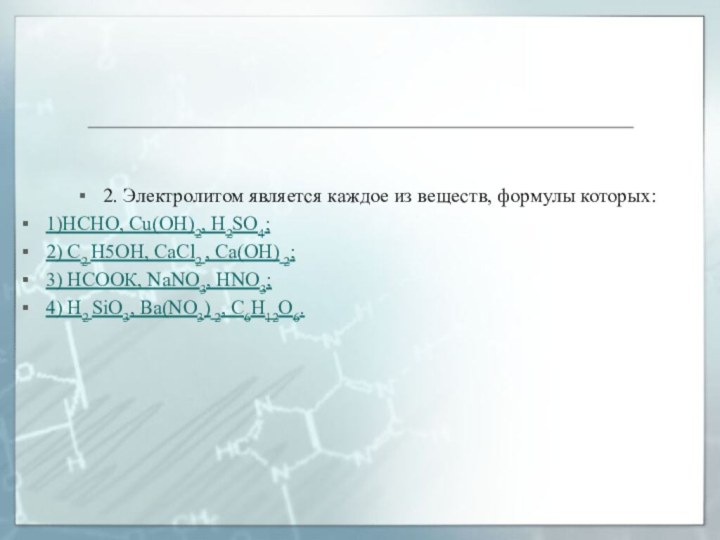
2. Электролитом является каждое из веществ, формулы которых:
1)HCHO, Cu(OH)2, H2SO4;
2) С2 Н5ОН, CaCl2 , Са(ОН) 2;
3)
НСООК, NaNO3, HNO3;
4) Н2 SiO3, Ba(NO3) 2, C6H12O6.
Слайд 4
3. Формула вещества, которое не является электролитом:
1) Ba(OH)
2;
2) KI;
3) CH3COOCH3;
4)HNO3 .
Слайд 5
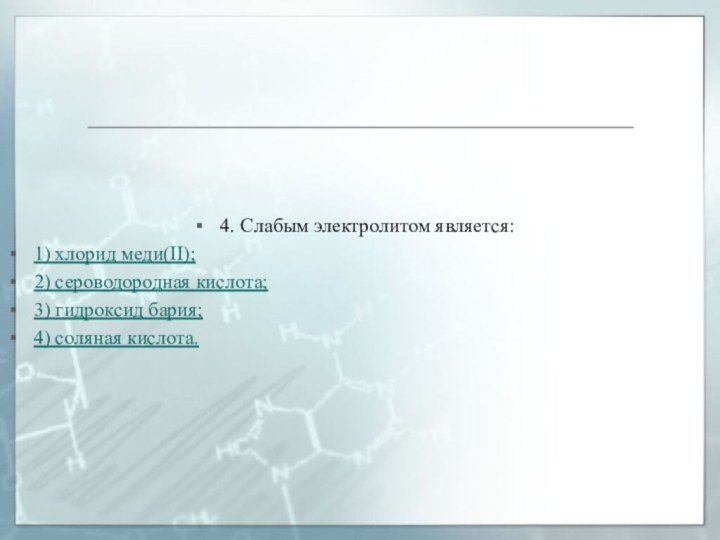
4. Слабым электролитом является:
1) хлорид меди(II);
2) сероводородная кислота;
3)
гидроксид бария;
4) соляная кислота.
Слайд 6
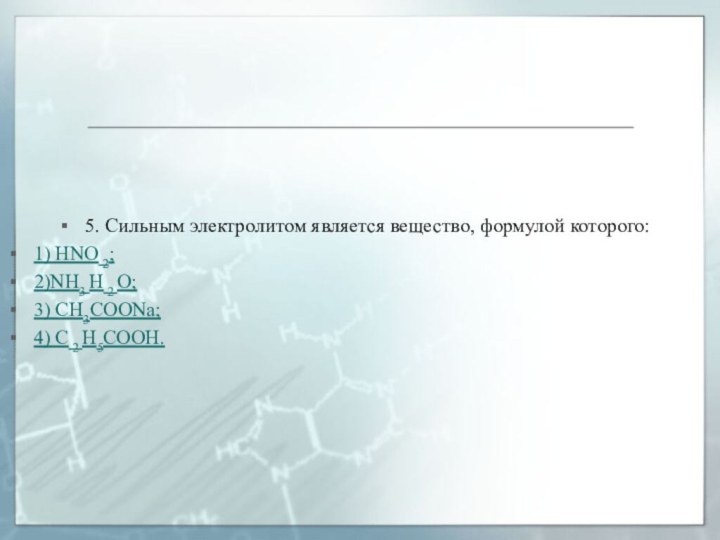
5. Сильным электролитом является вещество, формулой которого:
1) HNO
2;
2)NH3 H 2 O;
3) CH3COONa;
4) C 2 H5COOH.
Слайд 7
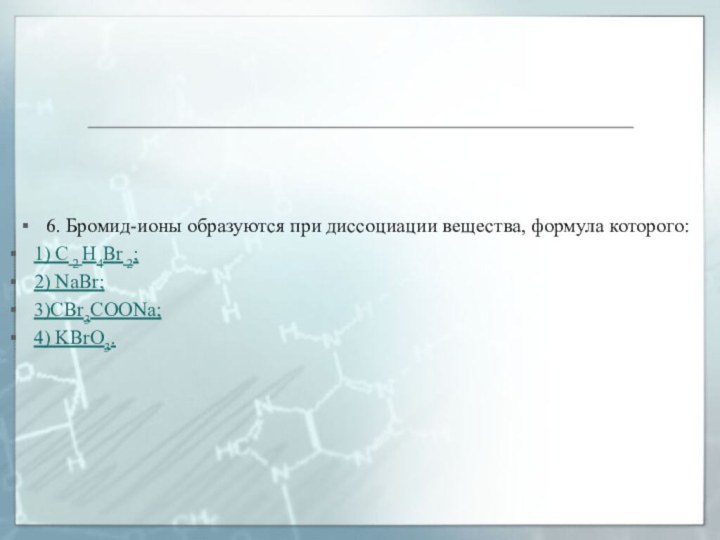
6. Бромид-ионы образуются при диссоциации вещества, формула которого:
1)
С 2 Н4Вr 2;
2) NaBr;
3)CBr3COONa;
4) KBrO3.
Слайд 8
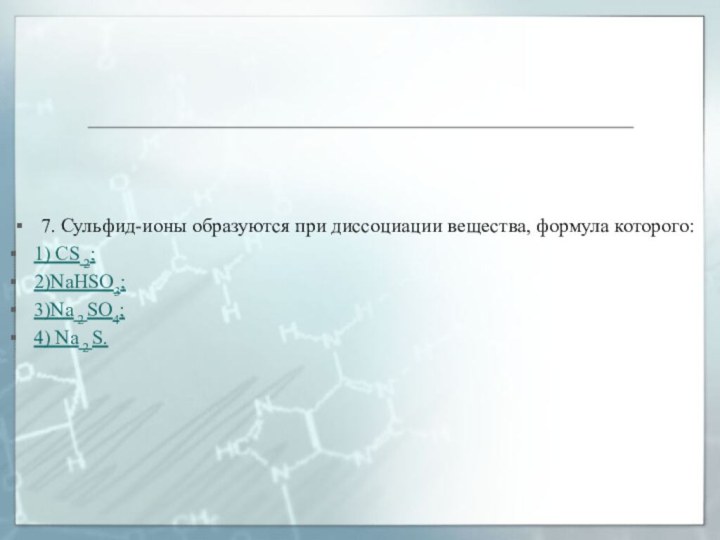
7. Сульфид-ионы образуются при диссоциации вещества, формула которого:
1)
CS 2;
2)NaHSO3;
3)Na 2 SO4;
4) Na 2 S.
Слайд 9
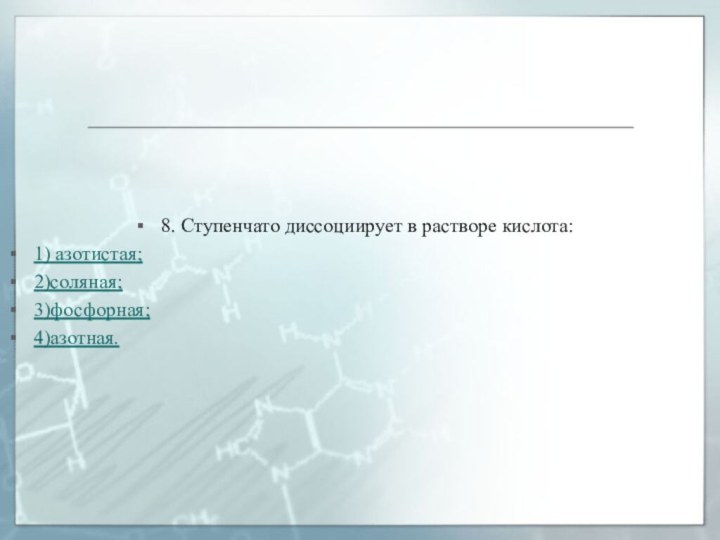
8. Ступенчато диссоциирует в растворе кислота:
1) азотистая;
2)соляная;
3)фосфорная;
4)азотная.
Слайд 10
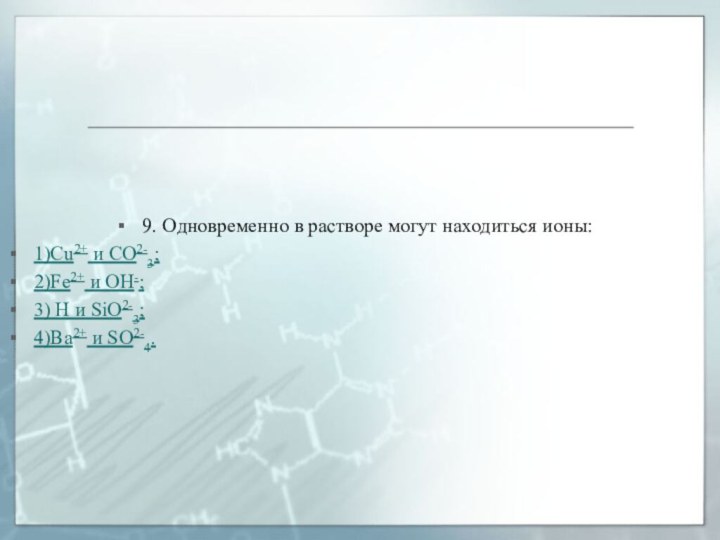
9. Одновременно в растворе могут находиться ионы:
1)Cu2+ и
CO2-3;
2)Fe2+ и OH-;
3) H и SiO2-3;
4)Ba2+ и SO2-4.
Слайд 11
10. Одновременно в растворе не могут находится ионы:
1)Ba2+ и NO -3
2) Mg2+ и Cl-;
3) Ca2+
и CO2- 3;
4) K и SO2- 4.
Слайд 12
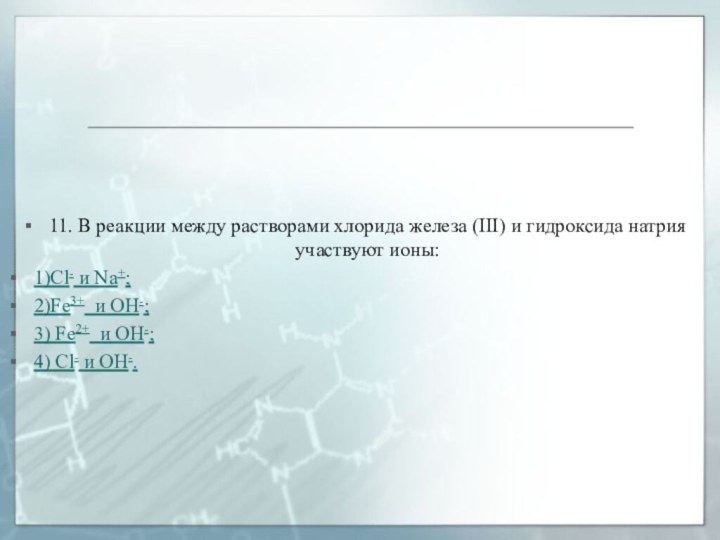
11. В реакции между растворами хлорида железа (III)
и гидроксида натрия участвуют ионы:
1)Cl- и Na+;
2)Fe3+ и OH-;
3)
Fe2+ и OH-;
4) Cl- и OH-.
Слайд 13
12. С образование осадка протекает реакция между растворами:
1)сульфата аммония и гидроксида натрия;
2) карбоната натрия и азотной
кислоты;
3) хлорида бария и нитрата серебра;
4) гидроксида натрия и серной кислоты.
Слайд 14
13. С образованием газа протекает реакция между растворами:
1)
гидроксида бария и азотной кислоты;
2) серной кислоты и силиката
натрия;
3) карбоната калия и нитрата кальция;
4) гидроксида натрия и хлорида аммония.
Слайд 15
14. С образованием воды протекает реакция между растворами:
1) гидроксида калия и сульфата аммония;
2) карбоната натрия и
хлорида кальция;
3) гидроксида бария и хлороводорода;
4) гидроксида бария и сульфата аммония.
Слайд 16
15. Нерастворимая соль образуется при взаимодействии растворов:
1) силиката
натрия и серной кислоты;
2) гидроксида натрия и хлорида меди
(II);
3) нитрата серебра и бромида натрия;
4) гидроксида натрия и нитрата аммония.
Слайд 17
16. С образованием осадка раствор гидроксида бария взаимодействует
с раствором вещества, формула которого:
1) HNO3;
2) Na2 CO3;
3) CH3COOH;
4)
NH4Cl.
Слайд 18
17. С образованием газа соляная кислота взаимодействует с
раствором вещества, формула которого:
1) Mg (OH)2;
2) Na2 SiO
3;
3) Na2 CO 3;
4) Ag NO 3.
Слайд 19
18. Соль и нерастворимое основание образуется в реакции
между растворами:
1) хлорида алюминия и избытка гидроксида натрия;
2) гидроксида
натрия и нитрата аммония;
3) гидроксида натрия и серной кислоты;
4) гидроксида калия и хлорида железа (II).
Слайд 20
19. Сокращенное ионное уравнение
H + + OH-
= H2O
соответствует реакции между:
1)Растворами серной кислоты и гидроксида бария;
2)
Раствором азотной кислоты и гидроксидом меди (II);
3) Соляной кислотой и гидроксидом алюминия;
4) Бромоводородной кислотой и гидроксидом калия.
Слайд 21
20. Сокращенное ионное уравнение
Ca 2+ + SO2-4 =
CaSO4
соответствует реакции между:
1) Карбонатом кальция и раствором серной
кислоты;
2) Растворами серной кислоты и хлорида кальция;
3) Раствором нитрата кальция и сульфатом бария;
4) Растворами хлорида кальция и сульфида натрия.
Слайд 22
21. Сокращенное ионное уравнение
Fe 2+ + 2OH-
= Fe(OH) 2
Соответствует реакции между веществами, формулы которых:
1) FeS и NaOH(р-р);
2) FeSO4(р-р) и NaOH(р-р);
3) FeCl3(р-р) и KOH(р-р);
4) Fe(NO3)2 (р-р) и Cu(OH)2.