- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Жидкие вещества
Содержание
- 2. Жидкость Жидкость — одно
- 3. ЖидкостьФизические свойства жидкостейТекучестьКипениеИспарение и конденсацияОбразование свободной
- 4. Самое важное и уникальное вещество на нашей
- 5. Физические свойстваВода представляет собой прозрачную бесцветную жидкость,
- 6. Физические свойстваРедкой особенностью воды является то, что
- 7. Химические свойстваХимические свойства В связи с тем,
- 8. Взаимодействует с щелочными и щелочно-земельными металлами: Ca+2H2O=Ca(OH)2+H2)Взаимодействует
- 9. Интересные факты Потеря организмом человека более 10 %
- 10. Среди существующих в природе жидкостей вода обладает
- 11. Круговорот воды в природеКруговорот воды в природе
- 12. Водные ресурсы ЗемлиОбщий объем водных запасов на
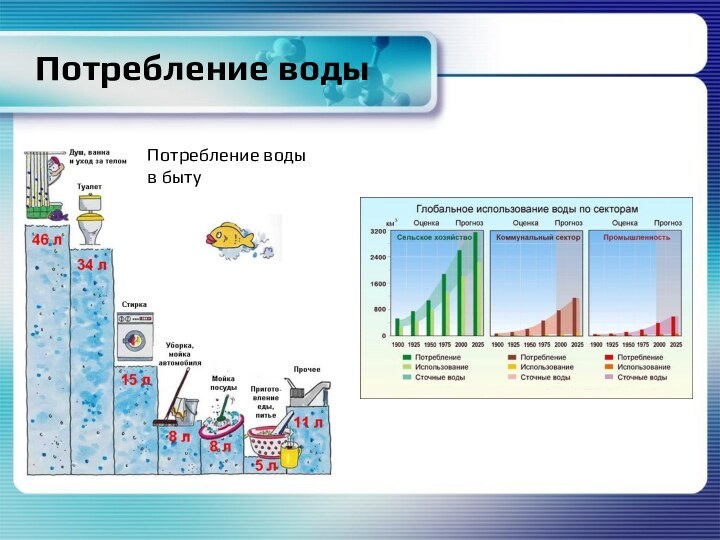
- 13. Потребление водыПотребление воды в быту
- 14. Жёсткость водыЖёсткость воды — совокупность химических и
- 15. Жесткость водыЖёсткая вода при умывании сушит кожу,
- 16. Жидкие кристаллыЖи́дкие криста́ллы (сокращённо ЖК) — вещества,
- 17. Скачать презентацию
- 18. Похожие презентации
Жидкость Жидкость — одно из агрегатных состояний вещества. Основным свойством жидкости, отличающим её от других агрегатных состояний, является способность неограниченно менять форму под действием механических напряжений, даже сколь угодно малых, практически сохраняя при
















Слайд 3
Жидкость
Физические свойства
жидкостей
Текучесть
Кипение
Испарение и конденсация
Образование свободной поверхности
и поверхностное натяжение
Вязкость
Сохранение объёма
Смачивание
Смешиваемость
Диффузия
Перегрев и переохлаждение
Волны плотности
Волны на
поверхности
Сосуществование
с другими фазами
Слайд 4 Самое важное и уникальное вещество на нашей планете
– это вода
Вода́ (оксид водорода) — прозрачная жидкость, не
имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Слайд 5
Физические свойства
Вода представляет собой прозрачную бесцветную жидкость, обладающую
целым рядом аномальных физических свойств. Например, она имеет аномально
высокие температуры замерзания и кипения, а также поверхностное натяжение. Ее удельные энтальпии испарения и плавления (в расчете на 1 г) выше, чем почти у всех остальных веществ.
Слайд 6
Физические свойства
Редкой особенностью воды является то, что ее
плотность в жидком состоянии при 4°С больше плотности льда.
Поэтому лед плавает на поверхности воды.Эти аномальные свойства воды объясняются существованием в ней водородных связей, которые связывают между собой молекулы как в жидком, так и в твердом состоянии. Вода плохо проводит электрический ток, но становится хорошим проводником, если в ней растворены даже небольшие количества ионных веществ. Вода – универсальный растворитель.
Слайд 7
Химические свойства
Химические свойства
В связи с тем, что
вода является наиболее важным растворителем на Земле, большая часть
химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.Вода является и кислотой и основанием одновременно (катион H+ анион OH-), и в связи с этим имеет одинаковую концентрацию гидроксид-ионов и ионов водорода (или ионов гидроксония). Этим объясняются необычные свойства воды.
Слайд 8
Взаимодействует с щелочными и щелочно-земельными металлами: Ca+2H2O=Ca(OH)2+H2)
Взаимодействует с
галогенами:
H2O+Cl2 HCl+HClO
С оксидами, с образованием щелочей или
кислот: BaO+H2O=Ba(OH)2
SO3+H2O=H2SO4
www.themegallery.com
Химические свойства
Слайд 9
Интересные факты
Потеря организмом человека более 10 % воды может
привести к смерти.
В среднем в организме растений и животных
содержится более 50 % воды.В организме человека вода составляет около 65 %.
В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане.
При средней глубине в 4 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
Морская вода замерзает при температуре -1,91 °C.
Слайд 10 Среди существующих в природе жидкостей вода обладает наибольшей
теплоемкостью.
Среди существующих в природе жидкостей поверхностное натяжение воды уступает
только ртути.Вода является универсальным растворителем.
Теплота ее испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку.
Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лед океана проникает только 2 % солнечного света.
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
www.themegallery.com
Интересные факты
Слайд 11
Круговорот воды в природе
Круговорот воды в природе (гидрологический
цикл) — процесс циклического перемещения воды в земной биосфере. Состоит
из испарения, конденсации и осадков. Скорость оборота для воды выше, чем для углекислого газа.Моря теряют из-за испарения больше воды, чем получают с осадками, на суше — положение обратное.
Слайд 12
Водные ресурсы Земли
Общий объем водных запасов на Земле
составляет ~1,4 миллиарда куб.км. Объем запасов пресной воды ~35
миллионов куб.км, или 2,5% от общего объема глобальных водных ресурсов. Из этих запасов пресной воды ~24 миллионов куб.км или 68,9% от общего объема пресных вод хранится в виде льда и вечных снегов в горных регионах, а также в Арктике и Антарктике. Около 8 миллионов куб.км пресной воды или 30,8% сосредоточено в виде подземных вод (подземные горизонты глубиной до 2000 м, почвенная влага, заболоченные угодья и вечная мерзлота). Эта категория пресноводных ресурсов составляет 97% от всех запасов пресной воды, потенциально доступных для использования человеком.
Слайд 14
Жёсткость воды
Жёсткость воды — совокупность химических и физических
свойств воды, связанных с содержанием в ней растворённых солей
щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой.Различают временную жёсткость, образованную гидрокарбонатами и постоянную жёсткость, вызванную присутствием других солей. Временная жёсткость может быть устранена кипячением.
И временная, и постоянная жесткость воды
легко устраняются добавлением соды
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Ca 2+ + CO⅔- = CaCO3





























