- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фармацевтическая разработка лекарств
Содержание
- 2. ФармразработкаФармразработка готовых лекарственных средств (ГЛС)Докладчик: Сьюзен УолтерсEmail: susanw@netspeed.com.au
- 3. Австралийский взгляд на мир
- 4. Что Австралия дала миру (1)
- 5. Что Австралия дала миру (2)
- 6. Фармразработка ГФППлан выступленияМы:взглянем на процесс разработки в
- 7. Цели фармразработки: Каково ее назначение?С точки
- 8. Цели фармразработки: Каково ее назначение?С точки
- 9. Определить препарат и схему приема для педиатрического
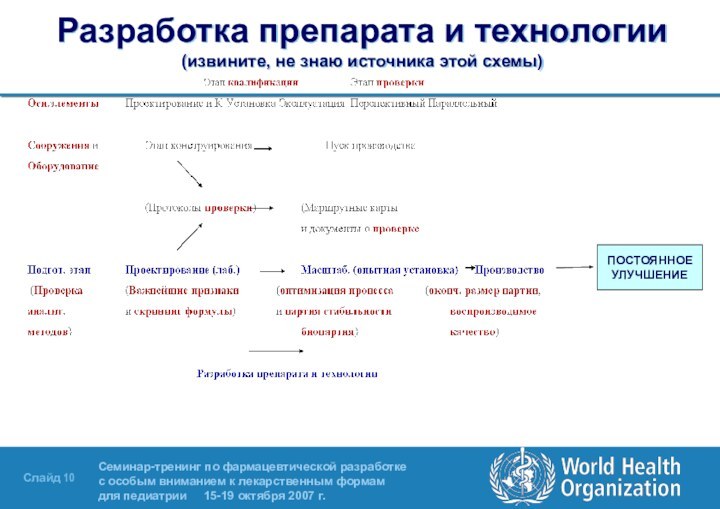
- 10. Разработка препарата и технологии (извините, не знаю источника этой схемы)ПОСТОЯННОЕУЛУЧШЕНИЕ
- 11. Терминология – из МКГ Q1A(R2) 2003
- 12. Применимые руководящие документы, изданные не ВОЗМКГ Q8
- 13. Применимые руководящие документы ВОЗ«Фармразработка», часть 3.2. «Руководства
- 14. Некоторые важные журналыPharmaceutical Technology (Фармацевтическая технология)Pharmaceutical Technology
- 15. Некоторые важные веб-сайтыhttp://www.who.int/medicines/en/. Программа ВОЗ по лекарственным
- 16. Как оптимизировать возможность разработки приемлемого препарата? -
- 17. Как оптимизировать возможность разработки приемлемого препарата? -
- 18. Каковы химические и физико-химические свойства АФИ, которые
- 19. Какую литературу следует искать?Ищем……ООО ВОЗ, если он
- 20. Анализ ситуации: новая марка пероральной суспензии «Невирапин»,
- 21. Анализ ситуации: новая марка пероральной суспензии «Невирапин»,
- 22. Какие полезные источники информации мы нашли?ЕООО: http://www.emea.europa.eu/humandocs/PDFs/EPAR/Viramune/109697en6.pdf
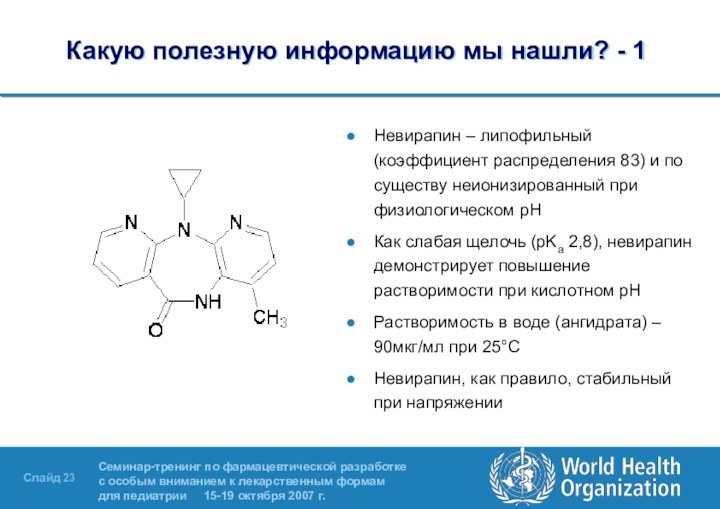
- 23. Какую полезную информацию мы нашли? - 1Невирапин
- 24. Какую полезную информацию мы нашли? - 2Существуют
- 25. Какую полезную информацию мы нашли? - 3
- 26. Какую полезную информацию мы нашли? - 4
- 27. Какую полезную информацию мы нашли? - 5Бутылка
- 28. Какую полезную информацию мы нашли? - 6Данные
- 29. Какую полезную информацию мы нашли? - 7Данные
- 30. Какую полезную информацию мы нашли? - 8На
- 31. Контрольные испытания оригинального препарата– 1 (эти
- 32. Контрольные испытания оригинального препарата– 2Качественный состав показывает,
- 33. Контрольные испытания оригинального препарата – 3
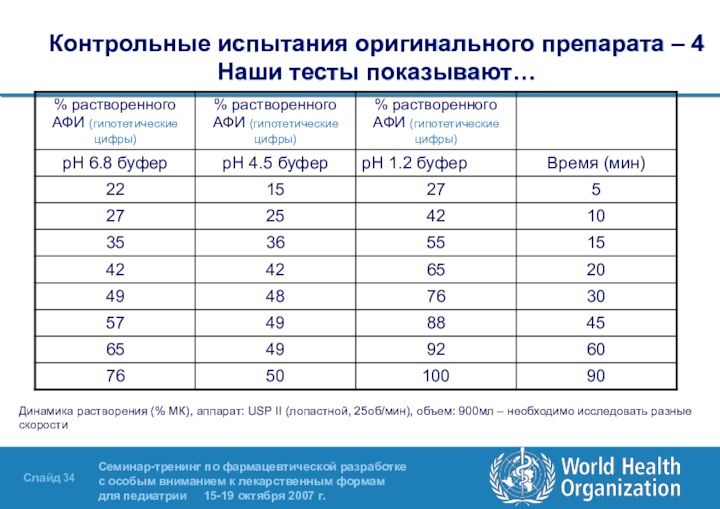
- 34. Контрольные испытания оригинального препарата – 4
- 35. Протокол фармразработкиЭксперименты с АФИГранулометрический составЭксперименты с рецептуройСкрининг
- 36. Свойства АФИ для конкретного препаратаСпецификации Международной фармакопеи
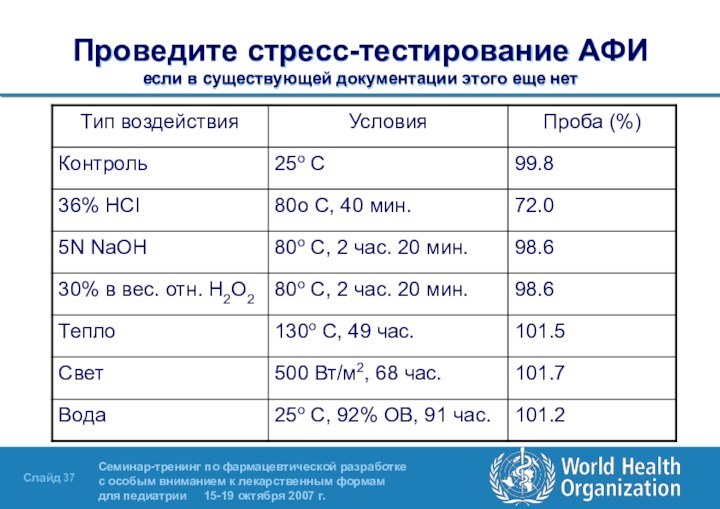
- 37. Проведите стресс-тестирование АФИ если в существующей документации этого еще нет
- 38. Растворимость полугидрата невирапина при 37oC если
- 39. Динамика растворения оригинального и генерического ГФП Гипотетические данныеСр.% Раств.АФИВремя (мин)▀ оригинал▀ генерикК-т подобияf2=73
- 40. Выбранный состав генерика Гипотетические цифры Ингредиенты мг/5млПолугидрат невирапина
- 41. Предлагаемые спецификации ГФП Гипотетический набор пределовОписание: в
- 42. Совместимость с наполнителями Этого можно не делать,
- 43. Разработка технологического процессаВыберите типовой процесс для пероральных
- 44. Разработка технологического процесса Отметим, что переход от
- 45. МасштабированиеПротестируйте большое количество образцов из опытных партий,
- 46. Испытание на растворимость и биоэквивалентностьОригинальное ГЛСГенерическое ГЛСПроведите
- 47. Скачать презентацию
- 48. Похожие презентации







































Слайд 2
Фармразработка
Фармразработка готовых лекарственных средств (ГЛС)
Докладчик: Сьюзен Уолтерс
Email: susanw@netspeed.com.au
Слайд 6
Фармразработка ГФП
План выступления
Мы:
взглянем на процесс разработки в целом
и рассмотрим его цели
пример с решением
Слайд 7
Цели фармразработки:
Каково ее назначение?
С точки зрения производителя
генериков цель состоит в разработке продукта, который:
имеет надлежащее качество
взаимозаменяем
с оригинальной маркой (чтобы мы могли избежать дорогостоящих и трудоемких исследований по безопасности и эффективности)
Слайд 8
Цели фармразработки:
Каково ее назначение?
С точки зрения производителя
новой лекарственной формы и (или) дозы (например, педиатрической лекарственной
формы) цель состоит в разработке продукта, который:имеет надлежащее качество
имеет надлежащую лекарственную форму и дозу
либо, как установлено, безопасен и эффективен для заявленных показаний и группы больных, либо, как установлено, фармакокинетически взаимозаменяем с маркой, которая, как установлено, безопасна и эффективна для заявленных показаний и группы больных
Вопросы безопасности и эффективности, однако, не входят в сферу моего выступления, поэтому я буду рассматривать только генерики, содержащие те же АФИ в той же лекарственной форме и дозе, что и оригинальный препарат
Слайд 9
Определить препарат и схему приема для педиатрического показания
Рассмотреть:
-
Подходящие пути введения
– Подходящие лекарственные формы
Рассмотреть фармакокинетические характеристики АФИ,
в том числе:- Период полувыведения, Кмах, ПФК
- Классификацию по СБК, если пероральное введение
Определить и подготовиться к исследования, которые могут потребоваться в отношении ВАВЕ
Определить:
- Соответствующие физико-химические характеристики АФИ
- Стабильности АФИ в условиях стресса
Совместимость АФИ с типовыми наполнителями
Изучить данные в литературе и (или) провести собственные исследования
Выбрать лекарственную форму и дозу
Подготовить проект информации о предписаниях
Рассмотреть подходящие рецептуры и технологические процессы
Изучить данные в литературе и (или) провести собственные исследования
Источники возможных рецептур и технологических процессов:
- Оригинальные наполнители
- Предыдущий опыт вашей компании
- Коммерчески доступные рецептуры и технологические процессы
- «Начальные» рецептуры ВОЗ
Подготовить предварительные партии и проверить соответствующие характеристики, в том числе:
- Скорость растворения
- Стабильность
- Пилотное исследование БЭ (если нужно)
Определить проектное пространство
Окончательно оформить информацию о предписаниях
Применить методы оптимизации/проверить рецептуру и технологию производства
Принять решение об окончательной рецептуре, технологии производства и упаковке
Провести:
- Подтверждающие исследования стабильности
- Подтверждающие исследования растворения
- Окончательное исследование БЭ, если необходимо
Подать заявку на предварительную квалификацию
Разработка педиатрической лекарственной формы
Слайд 10 Разработка препарата и технологии (извините, не знаю источника этой
схемы)
ПОСТОЯННОЕ
УЛУЧШЕНИЕ
Слайд 11
Терминология –
из МКГ Q1A(R2) 2003 (стабильность)
Серийная партия:
Партия
лекарственного средства или лекарственного препарата, изготовленная в производственном масштабе
с помощью производственного оборудования на указанном производственном предприятииОпытная партия:
Партия лекарственного средства или лекарственного препарата, изготовленная по технологии, которая полностью соответствует технологии, применимой к серийно производимой партии, и воспроизводит эту технологию. Для твердых пероральных лекарственных форм опытная партия обычно составляет минимум одну десятую часть полной серийной партии или 100 тыс. таблеток или капсул (в зависимости от того, какая из этих цифр больше).
Лабораторная партия [не определение МКГ]
Партия, меньшая, чем опытная партия, и изготовленная для целей разработки.
Помните, что масштабирование следует проверять – характеристики партий могут изменяться при масштабировании
Слайд 12
Применимые руководящие документы, изданные не ВОЗ
МКГ Q8 «Фармразработка»
(2005)
МКГ Q9 «Управление рисками качества» (ноябрь 2005)
МКГ Q10 ПРОЕКТ
«Система качества в фармацевтике» (май 2007)Примечание для руководства по проверке технологий CHMP/QWP/848/96 (ЕС 2001)
Старый документ, но информативный и полезный
Слайд 13
Применимые руководящие документы ВОЗ
«Фармразработка», часть 3.2. «Руководства по
подаче документов для предварительной квалификации многоисточниковых (генерических) готовых фармацевтических
препаратов (ГФП), применяемых в лечении ВИЧ/СПИДа, малярии и туберкулеза», ВОЗ PQP (2005)Продолжение Перечня стабильных АФИ (устойчивых к разложению АРВ) ВОЗ, дополнение 2 (редакция 1), к «Руководству по подаче документов для предварительной квалификации многоисточниковых (генерических) готовых фармацевтических препаратов (ГФП), применяемых в лечении ВИЧ/СПИДа, малярии и туберкулеза», ВОЗ PQP (2005)
Дополнительные руководящие указания по наилучшей практике производства: проверка, Приложение 4 к документу ВОЗ TRS 937 (2006)
Слайд 14
Некоторые важные журналы
Pharmaceutical Technology (Фармацевтическая технология)
Pharmaceutical Technology Europe
(Фармацевтическая технология в Европе)
Pharmaceutical Industry (Фармацевтическая промышленность)
Pharmaceutical Development and
Technology (Фармацевтическая разработка и технология)Drug Development & Industrial Pharmacy (Разработка лекарств и промышленная фармация)
Pharmaceutical Manufacturing (Фармацевтическое производство)
Dissolution Technologies (Технологии растворения) – бесплатный онлайновый журнал, http://www.dissolutiontech.com/
European Journal of Pharmaceutics and Biopharmaceutics (Европейский журнал по фармацевтике и биофармацевтике)
Pharmazie in Unserer Zeit (часто на немецком)
S.T.P. Pharma Pratiques (часто на французском)
Pharmaceutisch Weekblad (часто на немецком)
Часто возможно получить доступ к журналам через университетские интерактивные базы данных
Слайд 15
Некоторые важные веб-сайты
http://www.who.int/medicines/en/.
Программа ВОЗ по лекарственным средствам
http://mednet3.who.int/prequal/
Программа предварительной квалификации ВОЗ
http://www.ich.org
Веб-сайт Международной конференции по гармонизации (МКГ)
http://www.emea.europa.eu/htms/human/humanguidelines/background.htm
Европейcкие
руководящие указания по лекарствам для человекаhttp://www.fip.org/www2/sciences/index.php
Международная фармацевтическая федерация: секция фармацевтических наук
http://www.accessdata.fda.gov/scripts/cder/dissolution/index.cfm
Методы растворения лекарственных препаратов
Слайд 16
Как оптимизировать возможность разработки приемлемого препарата? - 1
Создать
коллектив разработчиков
Включить в него специалистов с опытом создания рецептур,
производства, контроля качества, проверки стабильностиПодготовить план разработки, установить цели и сроки, отслеживать прогресс путем проведения регулярных встреч (сначала еженедельных)
Использовать опытный персонал вашей компании, особенно связанный с производственным оборудованием и технологиями
Изучить литературу на предмет поиска информации:
о химических и физико-химических свойствах АФИ
об оригинальных препаратах
Провести эксперименты, чтобы заполнить пробелы в информации
Особенно в отношении свойств и совместимости АФИ
По возможности использовать те же наполнители, что и в оригинальном препарате.
Меньше вероятность столкнуться с проблемами совместимости, стабильности, биоэквивалентности
По возможности используйте типовые технологические операции, по которым у вашей компании есть опыт
Больше вероятность обеспечить подходящие свойства растворения и воспроизводимое производство
Слайд 17
Как оптимизировать возможность разработки приемлемого препарата? - 2
СУТЬ
ВОПРОСА:
Обеспечить, чтобы наш препарат соответствовал критериям ВОЗ по качеству,
стабильности и взаимозаменяемостиОбеспечить, чтобы наш препарат имел схожие с оригинальным препаратом характеристики растворения при различных значениях pH
Возможно, понадобится подтвердить биоэквивалентность с оригинальным препаратом
См. Приложение 8 к документу ВОЗ TRS 937 (2006) «Предложение от отказе от требований по биоэквивалентности в организме для твердых пероральных лекарственных форм мгновенного высвобождения Типового списка основных лекарств ВОЗ»
Слайд 18 Каковы химические и физико-химические свойства АФИ, которые нам
нужно знать или которые по крайней мере полезны?
Растворимость при
различных значениях pHКислота или щелочь?
pKa и коэффициент распределения
Стабильность при стрессе (например, кислород, влага, кислота и т.д.)
Совместимость с типовыми наполнителями
Слайд 19
Какую литературу следует искать?
Ищем……
ООО ВОЗ, если он есть
для вашего препарата
См. http://mednet3.who.int/prequal/default.htm. Ищите WHO Public Assessment Reports
(Открытые отчеты об оценке ВОЗ) в разделе Quick Links на правой стороне страницыДокументацию об оригинальном препарате.
Часто можно найти на веб-сайте производителя оригинального препарата.
Информация о предписаниях особенно полезно и часто включает перечень наполнителей.
Пакет утверждения препарата (ПУП) через http://www.fda.gov/cder/foi/nda/
ЕООО (Европейский открытый отчет об оценке)
Официальную монографию в Ph Int
Монографию в Clarke’s Analysis of Drugs and Poisons (издательство Pharmaceutical Press, последнее издание – 2004 г.).
Монографию в The Merck Index (издательство CambridgeSoft, последнее издание – 2001 г.).
Нормативную информацию
См., например, информационную линию ВОЗ e-drug@healthnet.org.
Слайд 20 Анализ ситуации: новая марка пероральной суспензии «Невирапин», 50
мг/5 мл - 1
Зачем нам нужно знать химическую структуру?
Чтобы
определить, чем является активное вещество – кислотой, щелочью или нейтральнымЧтобы содействовать разработке процедур анализа
Чтобы определить вероятную совместимость или несовместимость
На основании знания органической химии
Чтобы обосновать другие решения и прогнозы, основанные на химии
Слайд 21 Анализ ситуации: новая марка пероральной суспензии «Невирапин», 50
мг/5 мл - 2
Мы планируем разработать педиатрический препарат, который
содержит то же активное вещество, в той же дозе и форме, что и существующий педиатрический препарат. Производитель оригинального препарата - Boehringer Ingelheim. Фирменное название – пероральная суспензия «Вирамун» (Viramune®) 50 мг/5мл.
Разрабатываемый препарат – многоисточниковый (генерический) препарат.
Качество, безопасность и эффективность существующего препарата установлены.
Препарат будет представлять собой пероральную суспензию, содержащую 50 мг невирапина в каждых 5 мл. Лекарство присутствует как эквивалентное количество полугидратного АФИ.
Отметим, что АФИ часто является солью или сольватом активного ингредиента. В этом случае АФИ – полугидрат невирапина.
Слайд 22
Какие полезные источники информации мы нашли?
ЕООО: http://www.emea.europa.eu/humandocs/PDFs/EPAR/Viramune/109697en6.pdf
Пакет
утверждения препарата (ПУП): http://www.fda.gov/cder/foi/nda/98/20-933_20-636S009_Viramune.htm
Письмо с утверждением http://www.fda.gov/cder/ogd/rld/20933s3.PDF
Официальная монография в
Ph Int. Монография в Clarke’s Analysis of Drugs and Poisons (издательство The Pharmaceutical Press, 2004 г.).
Монография в The Merck Index (издательство CambridgeSoft, 2001 г. ).
Нормативная информация о возможной примеси в АФИ. См. http://www.medicalnewstoday.com/articles/82050.php
Слайд 23
Какую полезную информацию мы нашли? - 1
Невирапин –
липофильный (коэффициент распределения 83) и по существу неионизированный при
физиологическом pHКак слабая щелочь (pKa 2,8), невирапин демонстрирует повышение растворимости при кислотном рН
Растворимость в воде (ангидрата) – 90мкг/мл при 25°C
Невирапин, как правило, стабильный при напряжении
Слайд 24
Какую полезную информацию мы нашли? - 2
Существуют две
кристаллических формы АФИ
В напряженных состояниях полиморфические изменения не наблюдались
АФИ
(полугидрат) негигроскопиченСинтез двух кристаллических форм схож до этапа окончательной сушки
Характеристики профиля примесей четко определены
Примеси, являющиеся результатом синтеза, токсикологически квалифицированы
При проверке стабильности АФИ продуктов расщепления не выявлено
АФИ измельчается с целью получения приемлемого гранулометрического состава для суспензии
Невирапин официально описан в Международной фармакопее
Данные анализа партий подтвердили, что полугидрат невирапина соответствует спецификациям
Слайд 25
Какую полезную информацию мы нашли? - 3
Производитель
оригинального препарата продает пероральную суспензию (Viramune ® 50 мг/5
мл), содержащую невирапин (присутствует как полугидрат в концентрации 10,35 мг/мл).То есть активное вещество – невирапин, АФИ – полугидрат невирапина
Наполнители в оригинальной рецептуре:
Карбомер 934P (синтетические поперечно связанные полимеры акриловой кислоты с высоким молекулярным весом), метил- и пропилгидроксибензоаты, сорбитол, сахароза, полисорбат 80, NaOH, дистиллированная вода.
Срок годности оригинального препарата – 3 года.
Препарат следует использовать в течение 2 месяцев после вскрытия («эксплуатационная» стабильность).
Особых мер предосторожности при хранении производитель оригинального препарата не оговаривает.
Слайд 26
Какую полезную информацию мы нашли? - 4
Тара
оригинального препарата – бутылка из белого ПЭВП с двухэлементной
крышкой с защитой от доступа детей (наружная оболочка – белый ПЭВП, внутренняя оболочка – натуральный полипропилен) и пенной прокладкой из ПЭНП. Каждая бутылка содержит 240 мл пероральной суспензии.К оригинальному препарату прилагается дозировочный шприц на 5 мл (с делениями 0,2 мл) из чистого полипропилена, с силиконовым уплотнением поршня и переходником бутылка-шприц из чистого ПЭНП.
См.http://www.emea.europa.eu/humandocs/PDFs/EPAR/Viramune/109697en6.pdf
http://www.fda.gov/cder/ogd/rld/20933s3.PDF
Монография (Международная фармакопея) разрабатывается для ГФП, пероральной суспензии невирапина
Примечание: посмотрите последнюю информацию на сайте ВОЗ
Слайд 27
Какую полезную информацию мы нашли? - 5
Бутылка из
ПЭВП инертна и, как продемонстрировано, совместима с активным веществом
и другими ингредиентами рецептуры оригинального препарата.Процентное содержание противомикробных предохранительных добавок соответствует противомикробной эффективности при проверке по методологии Европейской фармакопеи
Имеются приемлемые данные, демонстрирующие точность и безошибочность дозировочного шприца оригинального препарата
Ни одна из примесей, образующихся при синтезе, не вызывает разложения
Метод подготовки пероральной суспензии - стандартный для этой лекарственной формы и хорошо описан. Данные проверки, представленные для трех производственных партий, изготовленных с использованием трех разных партий невирапина, продемонстрировали, что процесс контролируется и обеспечивает как воспроизводимость партий, так и соответствие стандартным спецификациям. Тесты при выпуске типичны и обеспечивают воспроизводимые характеристики препарата.
Слайд 28
Какую полезную информацию мы нашли? - 6
Данные о
стабильности оригинального препарата имеются на период до 18 месяцев.
Обещают, что данные о долгосрочной стабильности будут предоставляться на постоянной основе.Проведено исследование эксплуатационной стабильности, которое имитирует введение дозы 2 мл – одной из минимальных прогнозируемых доз – с помощью средства введения, предназначенного для продажи
Проведено дополнительное исследование стабильности препарата в условиях замерзания-оттаивания
На основании результатов этих исследований заявлен эксплуатационный срок годности 60 дней без особых мер предосторожности при хранении
Слайд 29
Какую полезную информацию мы нашли? - 7
Данные исследований
на живых организмах, предоставленные производителем оригинального препарата, включали следующее:
Невирапин
свободно всасывается (> 90%) после перорального приема у здоровых добровольцев и у взрослых, инфицированных ВИЧ-1.Трехстороннее перекрестное исследование, сравнивающее биологическую доступность трех производственных/коммерческих партий с разными параметрами растворения, показало, что все три партии были биоэквивалентны в отношении системного воздействия (ПФК). Статистически существенно различные значения Cmax и tmax оказались такими, что они были посчитаны клинически незначительными.
В исследованиях, где суспензия вводилась непосредственно с помощью шприца, было продемонстрировано, что рецептуры суспензии и таблеток были сравнимо биодоступными в отношении степени всасывания.
В исследовании, в котором суспензия вводилась с помощью дозировочной чашки без промывания, суспензия, предназначенная для продажи, была биоэквивалентна суспензии, использованной в клинических испытаниях, однако не была биоэквивалентна продаваемым таблеткам. Это объяснялось неполной дозировкой двух суспензий, потому что около 13% дозы оставалось в чашке.
Слайд 30
Какую полезную информацию мы нашли? - 8
На основании
опыта применения для взрослых для педиатрической группы был предложен
сравнимый начальный период в 2 недели. Для всех детей, независимо от возраста, предлагается доза 4 мг/кг. Хотя конкретных исследований для установления оптимальной начальной дозы не проводилось, эта доза считалась приемлемой, учитывая воздействие ферментов для обеспечения начальной антиретровирусной активности.Были утверждены следующие дозы:
Пациенты от 2 месяцев до 8 лет: 4 мг/кг один раз в день в течение 2 недель, затем 7 мг/кг два раза в день
Пациенты от 8 до 16 лет: 4 мг/кг один раз в день, затем 4 мг/кг два раза в день
Слайд 31 Контрольные испытания оригинального препарата– 1 (эти слайды взяты
из презентации Яноша Погани)
Получение образца для подтверждения характеристик
Номера партий
Срок
годности: 3 года и в течение 2 месяцев после вскрытияУказания по хранению: специальных мер предосторожности нет
Тара и система укупорки: согласно ЕООО
Анализ контроля качества (гипотетические цифры)
Пробирный анализ: 99.9% маркированного количества (МК)
Метилгидроксибензоат (ВЭЖХ) : 0.18% вес/объем
Пропилгидрокибензоат (ВЭЖХ) : 0.02% вес/объем
Всего связанных веществ: 0.03%
Относительный удельный вес (при 25oC): 1.150
Вязкость (при 25oC): 1,150 сП
pH: 5.80
Слайд 32
Контрольные испытания оригинального препарата– 2
Качественный состав показывает, что:
Сахароза
и сорбитол используются для корректировки плотности субстрата
Карбомер 934P используется
для корректировки вязкостиПолисорбат – смачивающий реагент
Гидроокись натрия используется для корректировки рН до 5.8
Слайд 33 Контрольные испытания оригинального препарата – 3 Наши тесты
показывают…
Динамика растворения (% маркированной дозы)
Аппарат: Фармакопея США USP II
(лопастной, 25 об/мин)Субстрат: 0.1N HCl
Объем: 900 мл
См. http://www.accessdata.fda.gov/scripts/cder/dissolution/dsp_SearchResults_Dissolutions.cfm загружен 13 марта 2007 г.
Слайд 34 Контрольные испытания оригинального препарата – 4 Наши тесты
показывают…
Динамика растворения (% МК), аппарат: USP II (лопастной, 25об/мин),
объем: 900мл – необходимо исследовать разные скорости
Слайд 35
Протокол фармразработки
Эксперименты с АФИ
Гранулометрический состав
Эксперименты с рецептурой
Скрининг лабораторных
партий с различными пропорциями наполнителей для совпадения с растворением
оригинального препаратаСтресс-тестирование избранного состава
Совместимость с наполнителями
Тест противомикробной эффективности согласно Европейской фармакопее
Упаковочные материалы
Размеры и допуски компонентов упаковки
Точность и безошибочность дозировочного шприца
Слайд 36
Свойства АФИ для конкретного препарата
Спецификации Международной фармакопеи +
пределы остаточных растворителей из производства АФИ
Физические свойства для конкретного
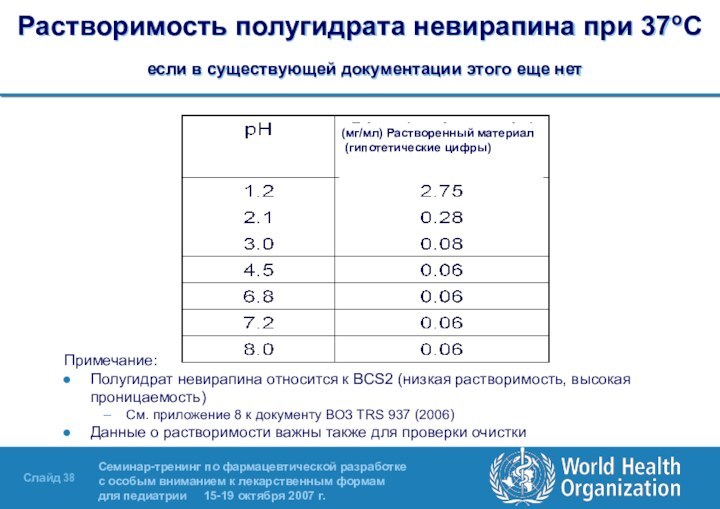
препарата зависят от кристаллизации и последующей физической обработки. Плотность и гранулометрический состав полугидрата невирапина – важнейшие признаки качества. Критерии приемлемости устанавливаются путем измерения размера частиц АФИ оригинального препарата в суспензии и на основании схожести характеристик растворения оригинального препарата и генерика.Слайд 38 Растворимость полугидрата невирапина при 37oC если в существующей
документации этого еще нет
Примечание:
Полугидрат невирапина относится к BCS2 (низкая
растворимость, высокая проницаемость)См. приложение 8 к документу ВОЗ TRS 937 (2006)
Данные о растворимости важны также для проверки очистки
Растворенный материал (мг/мл) (гипотетические цифры)
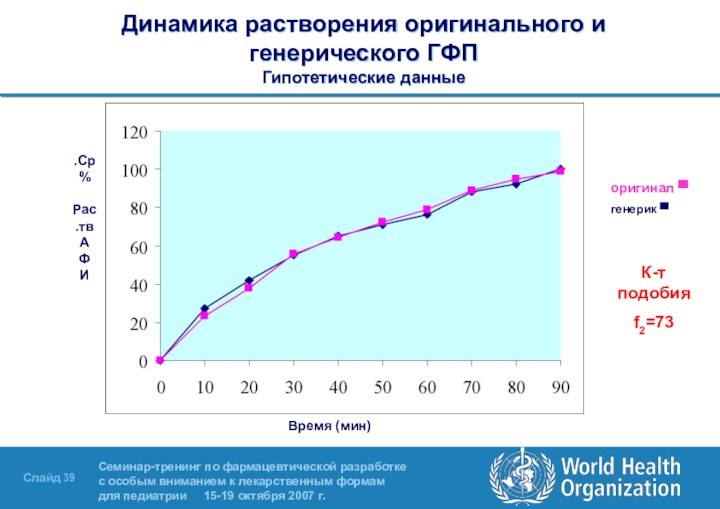
Слайд 39
Динамика растворения оригинального и генерического ГФП
Гипотетические данные
Ср.
%
Раств.
А
Ф
И
Время (мин)
▀ оригинал
▀ генерик
К-т подобия
f2=73
Слайд 40
Выбранный состав генерика
Гипотетические цифры
Ингредиенты мг/5мл
Полугидрат невирапина 51.7
Наполнители
Карбомер 934P
7.0
Метилпарагидроксибензоат 9.0
Пропилпарагидроксибензоат 0.9
Сорбитол 900.0
Сахароза (!) 500.0
Полисорбат 80
4.0Гидроокись натрия дост. кол-во
Дистиллированная вода до 5.0 мл
Слайд 41
Предлагаемые спецификации ГФП
Гипотетический набор пределов
Описание: в том числе
как минимум цвет, структура, запах
Определение (ВЭЖХ)
Растворение (УФ): Q =
70% за 45 минутpH = 5.0 – 6.1
Поставляемый объем
Средний объем наполнения: не менее 240 мл
Изменение объема наполнения: соответствует требованиям Ph Int
Связанные вещества: не более 0,1% любой примеси и не более 0,3% всех примесей
Содержание консервантов (ВЭЖХ)
метилпарабен: 98-102% маркированной дозы
пропилпарабен: 98-102% маркированной дозы
Проба: 95.0 - 105.0% маркированной дозы
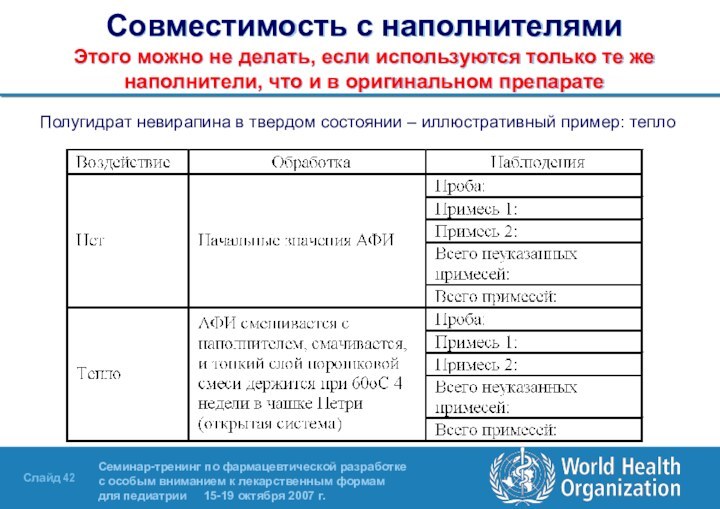
Слайд 42 Совместимость с наполнителями Этого можно не делать, если используются
только те же наполнители, что и в оригинальном препарате
Полугидрат
невирапина в твердом состоянии – иллюстративный пример: тепло
Слайд 43
Разработка технологического процесса
Выберите типовой процесс для пероральных водных
суспензий, если возможно – то с помощью нашего существующего
методаИзготовьте лабораторную партию
Если нужно, внесите изменения и изготовьте еще одну лабораторную партию
Если рецептура вас удовлетворяет, изготовьте опытную партию
Если нужно, внесите изменения и изготовьте еще одну опытную партию
Помните, что опытная партия изготавливается по технологии, которая полностью соответствует технологии, применимой к серийно производимой партии, и воспроизводит эту технологию
Изготовьте первичные* партии в предложенной таре и с предложенной системой укупорки для:
Исследований биоэквивалентности и растворения
Нормативных исследований стабильности
Включая исследование эксплуатационной стабильности и стресс-исследование в условиях замерзания-оттаивания
Проверки биоэквивалентности, растворения и партий стабильности
*Первичные – в соответствии с определением в руководящих документах ВОЗ/МКГ
Слайд 44
Разработка технологического процесса
Отметим, что переход от предварительной
к окончательной рецептуре, затем к опытному производству и, наконец,
к серийному производству должен быть описан в досье PQP, и должна быть доказана его логичность, обоснованность и непрерывность
Слайд 45
Масштабирование
Протестируйте большое количество образцов из опытных партий, чтобы
установить временные допустимые пределы для контроля важнейших технологических параметров
(перспективную проверку, внутренние контрольные пределы) с целью определения проектного пространства* и стратегии контроля, которая охватывает размер партии, оборудование, упаковку и стабильность конечного продукта. Процесс будет хорошо понятен, когда:будут выявлены и объяснены все важнейшие источники изменчивости
изменчивость будет контролироваться процессом
признаки качества продукта можно будет точно и достоверно предсказать
Составляется протокол проверки
* Дальнейшие пояснения см. в МКГ Q8, Q9 и проекте Q10
Слайд 46
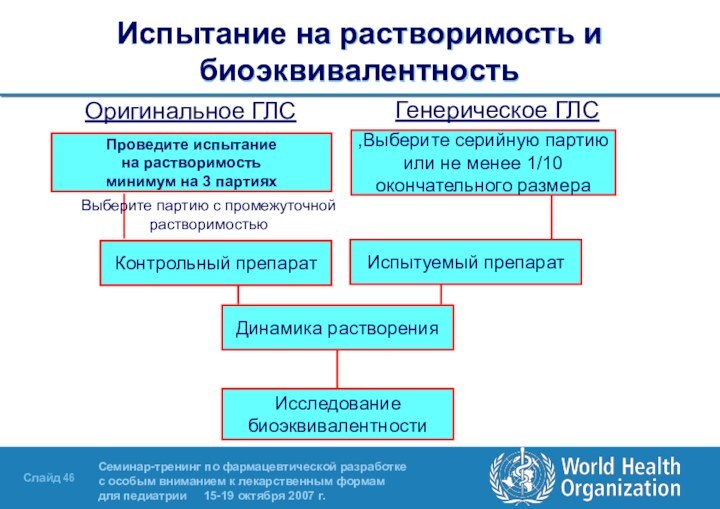
Испытание на растворимость и биоэквивалентность
Оригинальное ГЛС
Генерическое ГЛС
Проведите испытание
на растворимость
минимум на 3 партиях
Выберите серийную партию,
или не менее
1/10окончательного размера
Контрольный препарат
Испытуемый препарат
Выберите партию с промежуточной растворимостью
Динамика растворения
Исследование
биоэквивалентности