- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Генетические варианты КМП
Содержание
- 2. Учебная цельЗакрепить практические навыки ординаторов детских кардиологов по разделу “кардиомиопатии у детей”
- 3. ЗадачиЗнать: определние кардиомиопатиисоременную концепцтю этиологииУметь:своевременно установить диагнозсоставить план медикаментозной и хирургической коррекции
- 4. Кардиомиопатия I.42
- 5. КардиомиопатииЗаболевания миокарда неизвестной этиологии, характеризующиеся кардиомегалией и
- 6. Определениегетерогенная группа заболеваний миокарда, ассоциированнные с его
- 7. ОпределениеЗаболевания миокарда, характеризующиеся структурными и функциональными нарушениями
- 8. Кардиомиопатии - обширный класс заболеваний, характеризующихся структурными
- 9. Каждый из классов характеризуется своими морфологическими, физиологическими
- 10. Эпидемиология1 на 100,000 детского населения
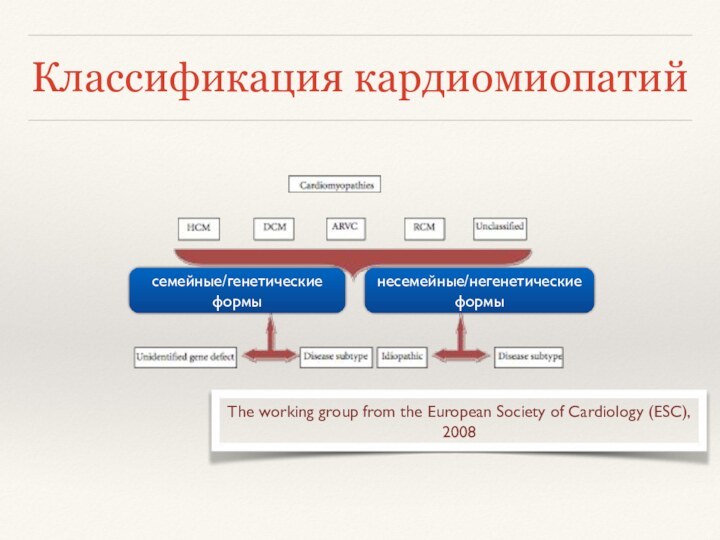
- 11. КлассификацияКардиомиопатиипоражение сердцаявляется следствием системного патологического процессаизолированное поражение сердца
- 12. Классификация кардиомиопатийсемейные/генетические формынесемейные/негенетические формы
- 13. ЭтиологияПричины:перенесенный миокардит
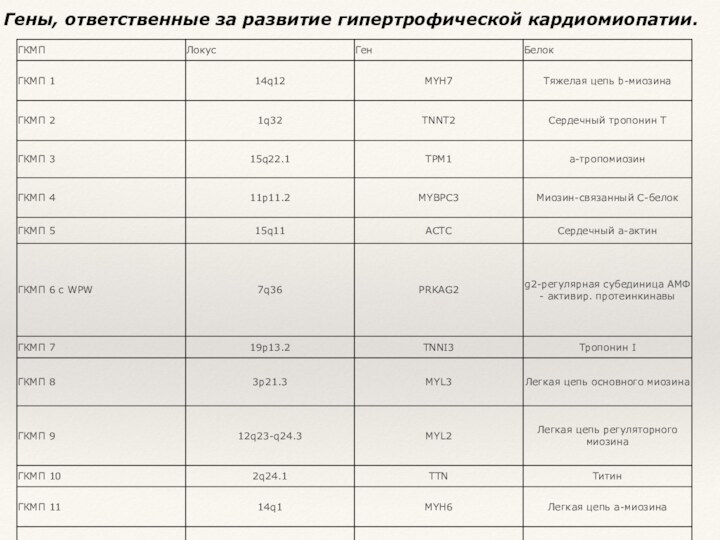
- 14. Гены, ответственные за развитие гипертрофической кардиомиопатии.
- 15. Семейные формы гипертрофической кардиомиопатии наследуются аутосомно-доминантно.Они обусловлены
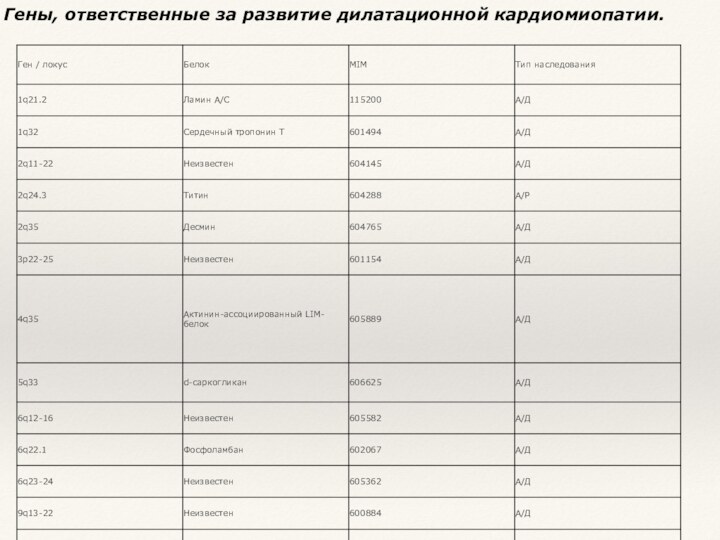
- 16. Гены, ответственные за развитие дилатационной кардиомиопатии.
- 17. В основе развития ДКМП лежат мутации генов,
- 18. III. Гены-модификаторы – гены, которые кодируют белки,
- 19. Белки цитоскелета. На сегодняшний день известно, что
- 20. Дистрофин – один из первых белков, мутации
- 21. Известны несколько типов мутаций в разных областях
- 22. Мутации гена дистрофина чаще всего ассоциируются с
- 23. В ряде случаев мутации в этом же
- 24. Кроме ДКМП при периферических миопатиях и Х-сцепленная
- 25. Известно, что данные белки в большом количестве
- 26. Мутации в гене G4.5, вызывающие синдром Барта,
- 27. КМП при периферических миопатиях2. Х-сцепленный эндокардиальный фиброэластоз.
- 28. КМП при периферических миопатиях3. Х-сцепленная форма изолированного
- 29. Мутации генов саркогликанового комплекса (саркогликанопатии). Саркогликанопатии чаще
- 30. Мутации генов саркогликанового комплекса (саркогликанопатии). Саркогликаны (a-,
- 31. Мутации гена a-саркогликана Этот протеин чаще называют
- 32. Мутации гена a-саркогликана Дефицит адалина (адалинопатия)Развитие ДКМП ассоциируется с тяжелыми аутосомно-рецессивными мышечными дистрофиями (LGMD, SCARMD).
- 33. Винкулин и его изоформа метавинкулинМутации в генах
- 34. Винкулин и его изоформа метавинкулинВ этих участках
- 35. Саркомерные белкиСаркомеры являются основной структурной и функциональной единицей миофибрилл – основного ультраструктурного компартмента КМЦ.
- 36. Саркомерные белкиМутации в генах, кодирующих белки саркомеров:актина,b-миозина,тропонинов
- 37. Саркомерные белкиОднако значительно позже было установлено, что
- 38. Первичные кардиомиопатии в МКБ 10Дилятационная
- 39. При ДКМП выявлены мутации в гене, кодирующем
- 40. Эти филаменты образуют соединение между ядерной и
- 41. В настоящее время мутациям генов вышеперечисленных групп
- 42. Мутации в генах, кодирующих транскрипционные факторы .В
- 43. Мутации в генах, кодирующих транскрипционные факторы .Одним
- 44. Мутации в генах белков, принимающих участие в
- 45. Мутации в генах белков, принимающих участие в
- 46. Терапия кардиомипатийПротокол терапии ХСН:ингибиторы ангиотензин конвертирующего факторабета-блокаторыдиуретики
- 47. Терапия кардиомипатийАнтиаритмические препаратыАнтикоагулянты
- 48. Скачать презентацию
- 49. Похожие презентации
Учебная цельЗакрепить практические навыки ординаторов детских кардиологов по разделу “кардиомиопатии у детей”











































Слайд 2
Учебная цель
Закрепить практические навыки ординаторов детских кардиологов по
разделу “кардиомиопатии у детей”
Слайд 3
Задачи
Знать:
определние кардиомиопатии
соременную концепцтю этиологии
Уметь:
своевременно установить диагноз
составить план
медикаментозной и хирургической коррекции
Слайд 5
Кардиомиопатии
Заболевания миокарда неизвестной этиологии, характеризующиеся кардиомегалией и недостаточностью
кровообращения, за исключением процессов, протекающих с поражением клапанов сердца,
коронарных, системных и легочных сосудов.
Слайд 6
Определение
гетерогенная группа заболеваний миокарда, ассоциированнные с его механической
и/или электрической диссфункций, которые обычно (но не постоянно) проявляются
дилятацией или гипертрофией желудочков в следствие влияния ряда причин, чаще генетических
Слайд 7
Определение
Заболевания миокарда, характеризующиеся структурными и функциональными нарушениями сердечной
мышцы в отсутствии, врожденных пороков сердца, артериальной гипертензии, клапанных
аномалий.
Слайд 8
Кардиомиопатии - обширный класс заболеваний, характеризующихся структурными изменениями
миокарда.
Классы кардиомиопатий:
гипертрофическая
дилятационная
рестриктивная
некомпактный миокард левого желудочка
Кардиомиопатии
Слайд 9 Каждый из классов характеризуется своими морфологическими, физиологическими и
клиническими конечными точками, отражающими различные патогенетические механизмы, приводящие к
заболеванию.Эти заболевания является наиболее частой причиной кардиогенной внезапной смерти (КВС) в молодом возрасте .
Кардиомиопатии
Слайд 11
Классификация
Кардиомиопатии
поражение сердца
является следствием системного патологического процесса
изолированное поражение сердца
Слайд 13
Этиология
Причины:
перенесенный миокардит
27%
диффузный нейро-мышечные
заболевания
22%,наследственные дефекты метаболизма 16 %
генетические синдромы 10%
Слайд 15
Семейные формы гипертрофической кардиомиопатии наследуются аутосомно-доминантно.
Они обусловлены миссенс-мутациями,
то есть заменами единичных аминокислот, в генах саркомерных белков. Относительная
частота мутаций при семейных формах гипертрофической кардиомиопатии.Слайд 17 В основе развития ДКМП лежат мутации генов, кодирующих
очень широкий спектр различных белков:
I. Гены, кодирующие структурные
белки: белки цитоскелета (дистрофин, ДАГ-комплекс, ламинина, саркогликановый комплекс; винкулин и его изоформа метавинкулин, десмин, титин, небулин, LIM-белок, Cypher/ZASP);
саркомерные белки (актин, b-миозин, тропонины Т, I и С, миозин-связывающий белок С;
белки ядерной оболочки (ламины А и С).
Слайд 18 III. Гены-модификаторы – гены, которые кодируют белки, принимающие
участие в:
сигнальной трансдукции,
репарации ДНК,
регуляции метаболизма и ионного гомеостаза (гены
HLA;гены, кодирующие ангиотензинпревращающий фермент, b-адренорецепторы, аденозинмонофосфатдеаминазу-1, гемохроматозассоциированный ген). Отдельную группу среди наследственных ДКМП составляют заболевания, обусловленные мутациями в митохондриальных ДНК (7,7–10 % случаев).
Слайд 19
Белки цитоскелета.
На сегодняшний день известно, что развитие
фенотипа ДКМП может быть обусловлено мутациями целого ряда генов,
локализованных в Х-хромосоме.Дистрофин-ассоциированный гликопротеиновый комплекс.
Основная функциональная роль дистрофин-ассоциированного гликопротеинового комплекса (ДАГ-комплекса) – обеспечение связи между актином, сарколеммой и внеклеточным матриксом миоцитов через ламинин-a2 [45, 50, 51].
В состав ДАГ-комплекса входят дистрофин, кавеолин-3, синтрофин, дистробревин, саркоспан и несколько субкомплексов: дистрогликановый (a-дистрогликан и b-дистрогликан), саркогликановый (a-, b-, g- и d-саркогликаны).
Слайд 20 Дистрофин – один из первых белков, мутации гена
которого стали ассоциировать с развитием ДКМП.
Относится к
группе цитоскелетных белков (соединяет цитоскелет с внеклеточным матриксом) и участвует во внутриклеточной организации ультраструктур кардиомиоцитов, стабилизации сарколеммы и передаче сокращений. Мутации гена дистрофина
Слайд 21 Известны несколько типов мутаций в разных областях гена
дистрофина.
Одной из первых была выявлена мутация в локусе Xp21
Х-хромосомы.Идентифицированы дупликация области от экзона 2 до экзона 7, вставки в интроне 11, точечные мутации в экзонах 9 или 29, а также делеции в области от экзона 48 до экзона 51.
Мутации гена дистрофина
Слайд 22 Мутации гена дистрофина чаще всего ассоциируются с развитием
мышечных дистрофий Дюшена и Беккера.
В 65 % случаев
обе формы периферической миопатии обусловлены делециями в экзонах 48-49 и 49-51. В результате таких мутаций происходит снижение, а иногда и полное исчезновение, уровня белка в миоцитах .
У части больных наряду с проявлениями периферических мышечных дистрофий выявляется поражение сердечной мышцы.
КМП при периферических миопатиях
Слайд 23 В ряде случаев мутации в этом же локусе
Xp21 ассоциируются с развитием изолированного фенотипа ДКМП, который называют
Х-сцепленная ДКМП.При этом, до 25 % таких мутаций специфично нарушают экспрессию М-изоформы дистрофина.
К таким мутациям относят вставку L1 в экзоне 1 М-изоформы, точечную мутацию в 3’-сплай-синговом сайте экзона 1 и делецию, в результате которой передвигаются М-промотер, экзон 1 и часть интрона 1
КМП при периферических миопатиях
Слайд 24 Кроме ДКМП при периферических миопатиях и Х-сцепленная ДКМП
, выделяют также синдром Барта.
Это заболевание значительно менее
известно. При синдроме Барта идентифицирован широкий спектр мутаций (делеции, вставки, нонсенс и смысловые мутации) в длинном плече Х-хромосомы в локусе Xp28 гена G4.5, который кодирует семейство белков – тафаззинов
КМП при периферических миопатиях
Слайд 25 Известно, что данные белки в большом количестве присутствуют
в клетках миокарда и скелетной мускулатуры.
Достаточно хорошо изучена
характеристика их на молекулярном уровне, однако до сих пор окончательно не выяснены их функциональные особенности. КМП при периферических миопатиях
Слайд 26 Мутации в гене G4.5, вызывающие синдром Барта, ассоциируются
с тремя различными фенотипами:
Х-сцепленная инфантильная ДКМП.
Заболевание развивается
в результате делеции, которая затрагивает экзон 8 гена G4.5 и приводит к полному исчезновению белков семейства тафаззинов.
Слайд 27
КМП при периферических миопатиях
2. Х-сцепленный эндокардиальный фиброэластоз.
Заболевание
связывают с мутацией, затрагивающей консервативную область экзона 10 гена
G4.5 и характеризуется развитием КМП, нейтропении и митохондриальных нарушений.
Слайд 28
КМП при периферических миопатиях
3. Х-сцепленная форма изолированного "некомпактного"
миокарда.
Данная форма определяется мутацией (Gly197Arg) в консервативной области
экзона 8 гена G4.5.
Слайд 29
Мутации генов саркогликанового комплекса (саркогликанопатии).
Саркогликанопатии чаще всего
обусловливают развитие тазово-плечевых мышечных дистрофий, однако в 10–30 %
случаев у таких пациентов может развиваться фенотип ДКМП.
Слайд 30
Мутации генов саркогликанового комплекса (саркогликанопатии).
Саркогликаны (a-, b-,
g- и d-саркогликаны) – белки очень тесно связанные друг
с другом.Поэтому мутации в гене, кодирующем один из протеинов данного комплекса, нередко вызывают частичный или тотальный дефицит всех четырех белков.
Слайд 31
Мутации гена a-саркогликана
Этот протеин чаще называют адалином.
Дефицит адалина (адалинопатия) может быть связан с мутациями в
генах, картированных на разных хромосомах: на хромосоме 17, на хромосоме 13q12 (кодирует дистрофин-ассоциированный белок массой 35 кД или g-саркогликан) и на хромосоме 4q12 (кодирует белок массой 43 кД или b-саркогликан).
Слайд 32
Мутации гена a-саркогликана
Дефицит адалина (адалинопатия)
Развитие ДКМП ассоциируется
с тяжелыми аутосомно-рецессивными мышечными дистрофиями (LGMD, SCARMD).
Слайд 33
Винкулин и его изоформа метавинкулин
Мутации в генах цитоскелетного
белка винкулина и его изоформе метавинкулине ассоциированы с развитием
ДКМП .Ген винкулина (VCL) картирован на хромосоме 10q22.1-q23. В КМЦ винкулин и метавинкулин локализуются в интеркалярных дисках и подсарколеммальных костамерах - в участках трансмиссии сократительного импульса.
Слайд 34
Винкулин и его изоформа метавинкулин
В этих участках винкулин
и метавинкулин взаимодействуют с a-актинином, талином и g-актином и
формируют микрофиламентозную сеть, связывающую цитоскелет с сарколеммой.
Слайд 35
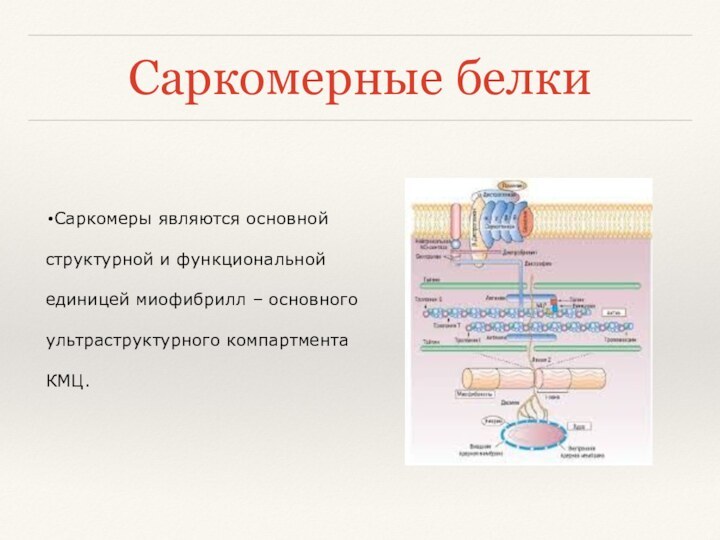
Саркомерные белки
Саркомеры являются основной структурной и функциональной единицей
миофибрилл – основного ультраструктурного компартмента КМЦ.
Слайд 36
Саркомерные белки
Мутации в генах, кодирующих белки саркомеров:
актина,
b-миозина,
тропонинов Т,
I, C,
миозин-связывающего белка С
были первоначально выявлены при изучении идиопатической
гипертрофической КМП .
Слайд 37
Саркомерные белки
Однако значительно позже было установлено, что развитие
семейной ДКМП также может быть вызвано мутациями в генах,
кодирующих данные белки.Результаты генетического анализа показали, что эти мутации затрагивают другие сайты.
Слайд 38
Первичные кардиомиопатии в МКБ 10
Дилятационная
I.42.0
Гипертрофическая
Рестрикстивная
Аритмогенная кардиопатия правого желудочка
I.42.1
I.42.3
I.42.4
Слайд 39
При ДКМП выявлены мутации в гене, кодирующем десмин
(DES).
Десмин – белок цитоскелета, который участвует в формировании промежуточных
филаментов III класса во всех типах мышечной ткани. Десмин
Слайд 40
Эти филаменты образуют соединение между ядерной и плазматической
мембранами.
Десмин также обнаружен в составе Z-дисков и интеркалярных
дисков и играет существенную роль в прикреплении и стабилизации саркомеров. Десмин
Слайд 41 В настоящее время мутациям генов вышеперечисленных групп белков
придают очень большое значение.
Согласно современным представлениям, одними из
наиболее вероятных механизмов патогенеза ДКМП являются: снижение генерации силы сокращений саркомерами в результате мутаций в генах саркомерных белков;
нарушение трансмиссии силовых импульсов в результате мутаций в генах цитоскелетных белков.
Слайд 42
Мутации в генах, кодирующих транскрипционные факторы .
В эксперименте
было показано, что к развитию ДКМП могут приводить мутации
в генах, которые кодируют транскрипционные факторы, контролирующие экспрессию генов КМЦ.
Слайд 43
Мутации в генах, кодирующих транскрипционные факторы .
Одним из
генов-кандидатов является ген CREB белка.
Данный протеин является основным
лейцин-замковым ядерным транскрипционным фактором, который играет важную роль в связывании с цАМФ и регулирует экспрессию генов, отвечающих на широкий спектр внешних сигналов. Слайд 44 Мутации в генах белков, принимающих участие в сигнальной
трансдукции, регуляции метаболизма и ионного гомеостаза
К таким генам,
например, относятся гены, кодирующие:АПФ,
HLA,
b-адренорецепторы,
аденозинмонофосфатдеаминазу-1,
гемохроматоз-ассоциированный ген (HFE) .
Слайд 45 Мутации в генах белков, принимающих участие в сигнальной
трансдукции, регуляции метаболизма и ионного гомеостаза
Доказано, что фенотипическая
изменчивость КМЦ определяется уровнем экспрессии большого количества генов, которые регулируют процессы развития, рецепторные взаимодействия, интенсивность процессов метаболизма, ионного гомеостаза. Генетический полиморфизм генов-модификаторов влияет на предрасположенность к развитию ДКМП.





























