Слайд 2
Для существования живой материи необходимы 27 из 92
химических элементов, присутствующих в земной коре.
Основные элементы, входящие в
состав биомолекул: углерод, водород, кислород, азот, фосфор, сера.
В виде ионов встречаются следующие элементы: натрий, калий, магний, кальций, хлор.
В виде микроэлементов существуют следующие: железо, медь, цинк, марганец, кобальт, йод, молибден, ванадий, никель, хром, фтор, селен, кремний, олово, бор, мышьяк.
В живых организмах в наибольших количествах встречаются четыре элемента – Н, О, С и N.
На их долю приходится 99% общей массы.
В настоящее время в биосфере насчитывают более 6 млн. химических соединений, не говоря уже о их комбинациях. Из всех веществ, содержащихся в биосфере, 90% имеют синтетическое происхождение и в подавляющем большинстве являются чужеродными для организма.
Слайд 3
КСЕНОБИОЛОГИЯ (от др. греч. ξενος чужой и λογία
наука) – наука, изучающая закономерности и пути поступления, выведения,
распространения, превращения чужеродных химических соединений в живом организме и механизмы вызываемых ими биологических реакций.
КСЕНОБИОТИК — любое химическое вещество, чуждое организму, сообществу или биосфере в целом, никогда ранее не присутствовавшее в перечисленных объектах, не вовлекаемое (или вовлекаемое с трудом) в круговорот веществ. Чужеродные вещества (ксенобиотики), попадая в организм человека и животных, претерпевают различную биотрансформацию: окисление, восстановление, гидролиз, конъюгацию и другие процессы с участием ферментных систем.
ТОКСИКАНТЫ – вещества или соединения, способные оказывать ядовитое действие на живые организмы.
Слайд 4
ЗАДАЧИ КСЕНОБИОЛОГИИ:
- установление структуры молекул метаболитов ксенобиотиков;
-
распределение метаболитов ксенобиотиков в организме;
механизмы реакций
превращения ксенобиотиков.
Число проблем, рассматриваемых в ксенобиологии, все возрастает. Это обусловлено тем, что ежегодно на Земле синтезируются десятки тысяч новых соединений. Ряд из них вовлекаются в круговорот веществ в природе. Чем шире масштабы производства химических соединений, тем большее влияние они оказывают на биологические процессы в почве, водоемах и на суше, тем сильнее проявляются побочные и отдаленные последствия их действия на живые системы.
Воздействие ксенобиотиков на живой мир, и на человека в частности, происходит в самых различных комбинациях этих соединений не только друг с другом, но и с факторами окружающей среды.
Слайд 5
СВЯЗЬ КСЕНОБИОЛОГИИ С ДРУГИМИ НАУКАМИ.
Ксенобиологию можно подразделить

на более узкие отрасли:
ксенобиофизику - физико-химическое описание как процессов
взаимодействия ксенобиотиков с клеточными структурами, в первую очередь с первичной мишенью их атаки - плазматической мембраной, так и механизмов их поступления.
ксенобиохимию - изучение метаболизма ксенобиотиков;
ксенофизиологию - изучение процессов жизнедеятельности и функции живых организмов на всем протяжении их развития в условиях действия ксенобиотиков. Особое значение в ксенобиологии имеют данные по метаболизму микроорганизмов, растений и животных, которые играют существенную роль в обезвреживании веществ антропогенного происхождения.
Ксенофитофизиология изучает особенности поступления и выделения, специфику процессов биотрансформации и аккумулирования ксенобиотиков в растительном организме.
Ксенобиология неразрывно связана с
• биохимией,
• биофизикой,
• физиологией,
• фармакологией,
• токсикологией,
• медициной,
• биотехнологией и т. д.
Слайд 6
Основные группы ксенобиотиков:
ксенобиотики естественного происхождения
ксенобиотики промышленного, особенно
химического производства;
радиоактивные вещества, электромагнитные поля;
ксенобиотики сельскохозяйственного производства:
химические препараты, применяемые в целях повышения урожайности (пестициды, азотистые минеральные удобрения), антибиотики и гормональные препараты, используемые в животноводстве для предупреждения заболеваний и стимуляции роста животных;
ксенобиотики микробного и паразитарного происхождения;
добавки к пищевым продуктам (красители, консерванты и др.), неправильно используемые в пищевой промышленности.
соединения, образующиеся в организме человека при определенных условиях.
Слайд 8
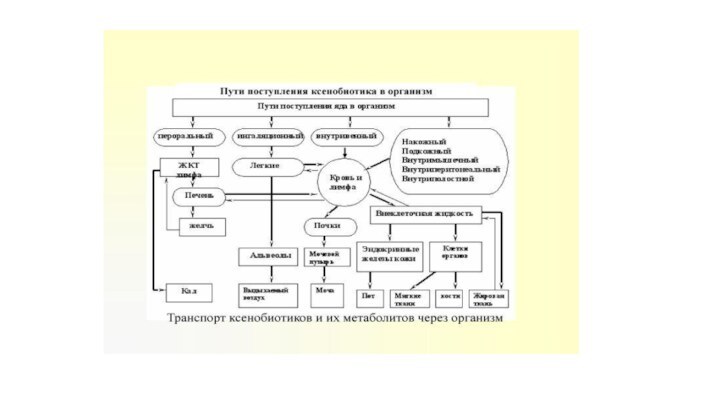
Пути загрязнения:
1. выброс в атмосферу → атмосферные осадки
→ почва → сельскохозяйственные растения → человек
2. промышленные и
бытовые отходы → вымывание → почва → кормовые растения → сельскохозяйственные животные → человек
3. сброс в поверхностные воды → водная флора и фауна→ рыба →человек.
Типы глобального химического загрязнения биосферы:
- газообразные вещества;
- тяжелые металлы;
- удобрения и биогенные элементы;
- органические соединения;
наночастицы и наноматериалы;
радиоактивными веществами (радионуклидами).
Слайд 9
Газообразные вещества:
- монооксид углерода;
-диоксид углерода;
-озон;
-окислы азота и серы;
-
галогенуглеводороды.
Источники поступления:
СО2 - сжигание ископаемого топлива, вырубки лесов,
окисления органического вещества почвы
СО - бытовые источники; пожары; химическая промышленность (производство аммиака, соды, синтез метанола, производство синтетических волокон, кокса); металлургическая промышленность; автотранспорт
NO и NO2 - сгорание ископаемого топлива; транспорт; производство азотной и серной кислот; бактериальное разложение силоса; курение.
SO2 - cжигание угля и нефтепродуктов; в металлургии; из сульфидных руд (колчеданов)
Слайд 10
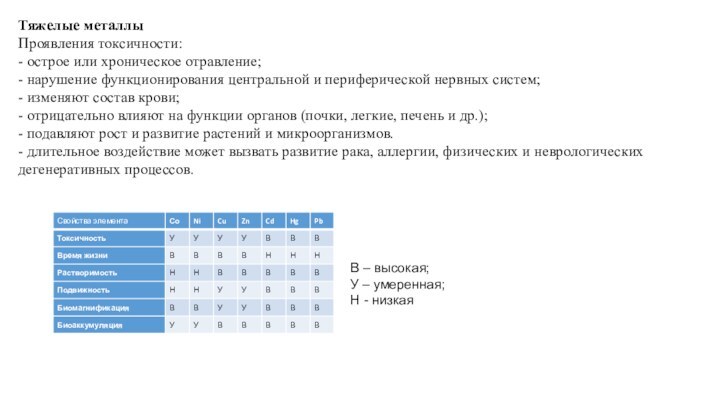
Тяжелые металлы
Проявления токсичности:
- острое или хроническое отравление;
- нарушение
функционирования центральной и периферической нервных систем;
- изменяют состав крови;
-
отрицательно влияют на функции органов (почки, легкие, печень и др.);
- подавляют рост и развитие растений и микроорганизмов.
- длительное воздействие может вызвать развитие рака, аллергии, физических и неврологических дегенеративных процессов.
В – высокая;
У – умеренная;
Н - низкая
Слайд 11
Органические соединения
- нефть и нефтепродукты;
-
пестициды (ФОП и ХОП);
- полихлорбифенилы (ПХБ);
поверхностно-активные вещества (ПАВ);
косметические и гигиенические средства.
Удобрения и биогенные элементы.
Общее потребление минеральных удобрений (N + Р2О5 + К2О) составляет около 100 млн. т в год.
Наноматериалы - материалы, содержащие структурные элементы, геометрические размеры которых хотя бы в одном измерении не превышают 100 нм, и обладающие качественно новыми свойствами, функциональными и эксплуатационными характеристиками. Это один из наиболее общих терминов для обозначения изолированных ультрадисперсных объектов. Твердые частицы размером менее 1 нм обычно относят к кластерам, более 100 нм — к субмикронным частицам.
Слайд 12
Основные поражаемые ксенобиотиками органы и системы:
-органы дыхания (развитие
различных форм острых поражений верхних дыхательных путей, бронхов, альвеолярного
аппарата);
- система крови (развитие гипопластических состояний, гипоксемического синдрома);
- гепатобилитарная система (токсический гепатит),
- иммунная система (токсико-аллергические повреждения);
- выделительная система (токсические нефропатии);
- нервная система (токсическая кома, токсические психозы, церебральные синдромы);
- кожа (химические ожоги, изъявления, аллергические дерматиты, токсикодермии).
Слайд 14
Методы, применяемые в ксенобиологии:
качественный и количественный химический
анализ,
физико-химические методы,
физические методы,
методы экологического мониторинга: биотестирование
и биоиндикация.
Основные этапы качественного и количественного определения ксенобиотиков:
экстракция,
разделение,
идентификация,
количественное определение.
Слайд 15
Тестирование биологической активности ксенобиотиков
Мониторинг - процесс наблюдения и
регистрации данных о каком-либо объекте на неразрывно примыкающих друг
к другу интервалах времени, в течение которых значения данных существенно не изменяются.
Биотестирование - процедура установления токсичности среды с помощью тест-объектов, сигнализирующих об опасности независимо от того, какие вещества и в каком сочетании вызывают изменения жизненно важных функций у тест-объектов.
Тест-объект - организм, используемый при оценке токсичности химических веществ, природных и сточных вод, почв, донных отложений, кормов и др.
Физико-химические методы
хроматография;
электрофорез;
цветные химические реакции и др.
Слайд 17
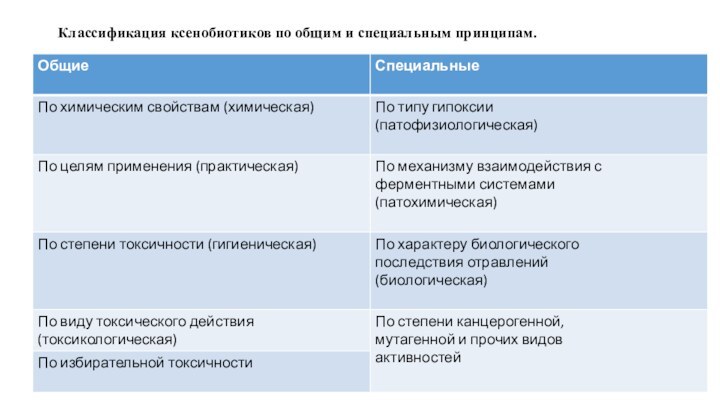
Классификация ксенобиотиков по общим и специальным принципам.
Слайд 18
Классификация ксенобиотиков в зависимости от источника происхождения и
практического применения:
1.Промышленные ксенобиотики, к которым относятся органические растворители (дихлорэтан,
тетрахлорметан, ацетон и др.); вещества, применяемые в качестве топлива (метан, пропан, бутан); красители (анилин и его производные; фреоны); химические реагенты, полупродукты органического синтеза и др.;
2.Химические удобрения и средства защиты растений, в том числе пестициды, направленные на уничтожение вредных насекомых, сорных растений, грибов и т. д.;
3. Лекарственные средства и полупродукты фармацевтической промышленности;
4. Бытовые химикаты, используемые в качестве инсектицидов, красителей, лаков, парфюмерно-косметических средств, пищевых добавок, антиоксидантов;
5. Растительные и животные яды;
6. Боевые отравляющие вещества.
Слайд 19
Токсикологическая классификация ксенобиотиков
Слайд 20
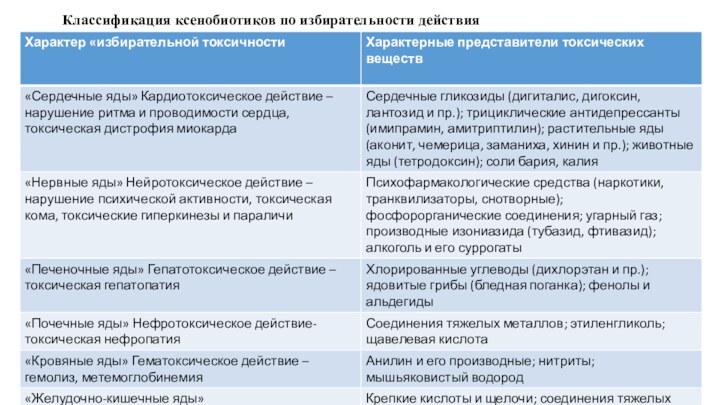
Классификация ксенобиотиков по избирательности действия
Слайд 21
Токсичность – мера несовместимости вещества с жизнью.
Опасность –
вероятность появления вредных для здоровья эффектов в реальных условиях
их производства и применения.
Классы токсичности (опасности):
I – чрезвычайно токсичные (опасные)
II - высоко токсичные (опасные)
III - умеренно токсичные (опасные)
IV – мало токсичные (опасные)
Слайд 22
Доза – количество вещества, введенное или попавшее в
организм (отнесенное как правило, единице массы тела человека или
животного) и дающее определенный токсический эффект.
Доза токсическая - доза, вызывающая в организме патологические изменения, не приводящие к смертельному исходу. Токсические дозы занимают диапазон доз от минимальной токсической до минимальной смертельной.
Доза токсическая минимальная (MTD) - это пороговая доза в отношении эффекта, выходящего за пределы нормальных физиологических реакций.
Доза смертельная минимальная (MLD) - доза, вызывающая за фиксированный период времени гибель единичных, наиболее чувствительных подопытных животных; принимается за нижний предел дозы смертельной.
Доза смертельная средняя (DL50) - доза, вызывающая за фиксированный период времени гибель 50% подопытных животных.
Доза смертельная абсолютная (DL100) - доза, вызывающая за фиксированный период времени гибель не менее, чем 99% подопытных животных.
Слайд 23
Принцип зависимости эффекта от концентрации (дозы) и времени
Для острых воздействий, которые регистрируются практически мгновенно, эффект зависит
от концентрации (дозы) и поэтому для их описания используется кривая «концентрация (доза) – эффект».
Для хронических воздействий, проявление которых связано с функциональной или материальной кумуляцией ксенобиотика, эффект зависит не только от концентрации (дозы), но и от времени воздействия, поэтому хронические эффекты описываются кривой «время – эффект».
Математическое описание процессов местного раздражающего, резорбтивного, специфического действий позволяет определить ряд показателей, необходимых для нормирования: коэффициент запаса, коэффициент кумуляции, пороги острого и хронического действия и др.
Слайд 24
Основные показатели токсичности:
UNIAC – порог однократного (острого) действия

токсического вещества – минимальная пороговая доза, вызывающая изменение показателей
жизнедеятельности, выходящие за пределы приспособительных физиологических реакций (мг/кг);
DL50 и DL100 – среднесмертельная (смертельная) доза химического вещества, вызывающая гибель соответственно 50% и 100% подопытных животных при определенном способе введения (внутрижелудочно, внутрибрюшинно, на кожу) в течение 2-х недельного ( 14 дней ) последующего наблюдения (мг/кг);
CL50 и CL100 – доза (концентрация) химического вещества, вызывающая гибель 50% и 100% подопытных животных при ингаляционном воздействии в течение последующего 2-х недельного наблюдения (мг/м3);
ПДК – предельно- допустимая концентрация вещества в воздухе (мг/м3);
ОБУВ – ориентировочно безопасный уровень воздействия вещества (мг/м3);
Условно смертельная доза – минимальная доза, вызывающая смерть человека при однократном воздействии данного вещества (мг/кг);
Пороговая концентрация ядов в крови – концентрация ядов в крови, при которых обнаруживаются первые симптомы отравления (мг/мл);
Критическая концентрация – концентрация яда в крови, соответствующая развернутой картине отравлений (мг/мл);
Смертельная концентрация – концентрация яда в крови, при которой обычно наблюдается смертельный исход (мг/мл).
Слайд 25
Токсичность разных веществ определяется:
Способностью вещества достичь структуры-мишени,
взаимодействие с которой инициирует токсический процесс;
2. Характером и
прочностью связи, образующейся между токсикантом и структурой-мишенью;
3. Значением структуры-мишени для поддержания гомеостаза в организме.
Строение вещества определяет размеры молекулы, ее массу, растворимость, летучесть, агрегатное состояние при нормальных условиях и химическую активность. Все эти свойства влияют на токсичность вещества, вместе с тем ни одно из них не является единственно значимым.
Слайд 26
Живой организм – упорядоченная во времени и пространстве

система взаимосогласованных химических реакций, совокупное течение которых обеспечивает устойчивое
поддержание и развитие системы в направлении ее дублирования и воспроизводства.
Для организмов характерно множество протекающих химических реакций, разнообразие физико-химических и структурных свойств веществ, как попадающих, так и слагающих организм. Это создает предпосылку того, что и чужеродные для данного организма вещества обладают способностью воздействовать на живую материю: на ее молекулярные компоненты, молекулярно-мембранные и биохимические процессы, физиологические и психологические проявления жизнедеятельности. При этом биологическое действие веществ может быть ограничено любым из уровней и не проявляться на функциональном уровне организма в целом.
Многообразие химических соединений в организме обусловливает возможность его реакции практически с любым ксенобиотиком, попадающим в организм. Свойство живых систем быть реакционно способным по отношению к любому ксенобиотику приводит к тому, что все химические соединения обладают биологической активностью. Организм в свою очередь не остается безучастным к появлению чужеродного химического соединения, которое независимо от его биологической активности либо используется для своих нужд, либо выводится из него, либо остается в организме чужеродным, что в последнем случае вызывает более глубокую физиологическую реакцию.
Слайд 28
1. Каждая более высокая форма материи включает в

себя элементы более низкого уровня. По этой причине повреждающее
действие химических веществ на молекулярном уровне при определенных условиях отражается на состоянии биосистемы в целом.
2. С повышением уровня организации расширяется многообразие и сложность биологических систем. При этом существенно возрастают возможности их токсического повреждения ксенобиотиками, увеличивается разнообразие проявлений токсического процесса.
3. Каждая новая ступень организации живой материи приобретает качественно новые свойства. Токсическое действие веществ следует оценивать с учетом этих новых свойств, не ограничиваясь характеристикой эффектов, наблюдаемых на более низких ступенях организации живого.
4. Эволюция живой материи идет путем расширяющейся дифференциации и специализации составляющих биологическую систему элементов, с одновременным усилением их кооперации. Существует известная избирательность в действии токсикантов. Любая избирательность токсического действия носит условный характер. Повреждение элемента͵ так или иначе, сказывается на функциональном состоянии системы в целом.
5. Более высокие уровни организации материи предполагают усиление адаптивных возможностей, но требуют более совершенной системы координации составляющих её частей. В этой связи прослеживается закономерность: по мере усложнения организмов увеличивается число специфически действующих на них высоко токсичных соединений.
Слайд 29
• Стимуляция окислительно-восстановительных реакций. В этом случае ксенобиотики

могут выступать как доноры или акцепторы электронов, запуская редокс-реакции,
что также ведет к изменению структуры молекул.
Так как структура биологических макромолекул определяет их функцию, то описанные конформационные изменения макромолекул влекут за собой определенные функциональные изменения.
• Нарушение функции. Подобное проявление может иметь место при катализе какой-то ферментативной реакции, при эффекте мимикрирования (подражания) ксенобиотиком действию некоторых гормонов (например, половых).
• Изменение смысловой генетической информации. Речь идет об информации, заложенной в триплетной нуклеотидной последовательности ДНК. Последнее может быть причиной мутаций, в том числе злокачественной трансформации клетки.
• Образование антигенов. Определенные изменения третичной структуры белков могут вести к появлению иных в конформационном отношении макромолекул, которые могут обладать антигенными свойствами, формировать ответную иммунную реакцию и являться причиной аутоиммунных заболеваний у человека.
Молекулярный уровень.
Слайд 30
Клеточный уровень.
• Нарушение процесса экспрессии генов. Чаще

всего это выражается в нарушении транскрипции. Как известно, этот
процесс контролируется факторами транскрипции. Некоторые ксенобиотики, например полихлорированные бифенилы, атразин, способны действовать как лиганды и изменять активность факторов транскрипции, которые имеют белковую природу. Это, в частности, может быть причиной внутриутробных нарушений развития плода и сопровождается появлением уродств.
• Искажение внутриклеточной информации. Этот механизм обычно реализуется путем модуляции активности киназ (фосфорилаз), осуществляющих присоединение остатка фосфорной кислоты к белкам, и играет важную роль в передаче сигнала в клетку. Другим примером нарушений на клеточном уровне может являться эффект мимикрирования действия гормонов с помощью ксеноэстрогенов, а также ингибирование активности ферментов, расщепляющих естественные гормоны.
• Изменение клеточной активности. Это происходит путем изменения потенциалов действия в клетках нервной, мышечной тканей, изменения концентрации нейромедиаторов, рецепторных функций, внутриклеточной передачи сигнала и др.
• Изменение внутриклеточного метаболизма. Здесь два процесса играют доминирующую роль: окислительное фосфорилирование, сопряженное с синтезом АТФ, и поддержание на низком уровне концентрации внутриклеточного кальция.
Слайд 31
Основные способы реализации ксенобиотиками своего токсического воздействия на

организм человека:
1. Изменение метаболизма клеток или тканей, связанное с
нарушениями в организме и появлением определенной симптоматики.
2. Воздействие на клеточную ДНК, изменение генетической информации и ее реализация в виде злокачественной трансформации клетки. Подсчитано, что онкологическое заболевание развивается не сразу, а после того, как клетка накопит несколько (от 4 до 10) повреждений ДНК. Повреждения в структуре хромосом, вызванные действием ксенобиотиков, могут передаваться от поколения к поколению. Например, малые дозы нитрозаминов, вводимые беременным мышам индуцировали типичные опухоли не только у матерей, но и в последующих поколениях, хотя потомство мышей в последующем не имело никакого контакта с нитрозаминами.
3. Путем подражания действию естественных химических соединений (например гормонов), функционирующих в организме. При таком механизме действия ксенобиотики нарушают нормальный рост и развитие органов, тканей, включая нервную и иммунную систему.
4. Путем изменения активности иммунной системы у человека. Это воздействие включает иммунную модуляцию, выражающуюся в изменении активности иммунных компонентов (например, числа T— или B-лимфоцитов в крови), развитии гиперчувствительности и стимуляции аутоиммунных процессов в организме. Подобным действием отличаются ароматические углеводороды; карбаматы (класс пестицидов); тяжелые металлы (ртуть); галогенпроизводные ароматических углеводородов (полихлорированные соединения); фосфоорганические соединения (пестициды); металлоорганические соединения олова; атмосферные окислители (озон и диоксид азота); полициклические ароматические углеводороды (продукты сжигания угля, нефти, мусора).
Важная характерная черта ксенобиотиков — синергизм в их действии. Примеры канцерогенного синергизма: действие нитрозаминов с полихлорированными бифенилами (ПХБ), бенз[a]пирена со ртутью и др. Согласно имеющимся данным не существует даже очень малых доз ксенобиотиков, которые были бы не способны индуцировать рак из-за эффекта синергизма с другими соединениями.