- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Лейкозы
Содержание
- 2. ОпределениеЛейкоз (лейкемия, алейкемия, белокровие, неправильно «рак крови») — клональное злокачественное (неопластическое)
- 3. КлассификацияПо характеру течения:острые, из незрелых клеток (бластов),хронические,
- 4. Классификация. Острых лейкозов.Острый миелобластный лейкоз (М1)Анализ костного мозга:бластные
- 5. Классификация. Острых лейкозов.Острый миеломонобластный лейкоз (М4)Костный мозг:
- 6. Этиология. Химическая теория. Согласно ей в организме
- 7. Этиология. Вирусная теория.На протяжении ряда лет в
- 8. Этиология. Теория ионизирующей радиации. Ряд авторов указывают
- 9. Патогенез 1/2.Однако, вернёмся к острым лейкозам.В основе
- 10. Патогенез 2/2.Уменьшение количества эритроцитов влечет за собой
- 11. Клинические проявления. Клинические проявления одинаковы для
- 12. Диагностика острых лейкозовДля постановки диагноза «острый лейкоз»
- 13. Хронические лейкозы.Хронические лейкозы отличаются от острых дифференцировкой опухолевых клеток и
- 15. Хронический лимфоцитарный лейкоз (ХЛЛ).- это доброкачественная опухоль
- 16. Хронический лимфолейкоз под микроскопом
- 17. Хронический миелоцитарный лейкоз (ХМЛ).— хронический лейкоз, при
- 18. Хронический миелолейкоз под микроскопом
- 19. Патогенез.На уровне предшественника В-клетки происходит хромосомная аберрация,
- 21. Лабораторные методы исследования всех лейкозов.Пункция костного мозга
- 22. Дополнительные методы исследования.Рентгенологическое исследование органов грудной клетки:
- 23. Лечение острых лейкозов.В соответствии с современными представлениями
- 24. Лечение хронических лейкозов.Существует три основных способа:Назначение цитостатиков
- 25. Другие подходы в лечении лейкозов.Высокодозная химиотерапия с
- 26. Реабилитация. Диспансерное наблюдение.Реабилитация заключается в обеспечении полного
- 27. Профилактика лейкозов.Для профилактики лейкоза очень важно регулярно
- 28. Скачать презентацию
- 29. Похожие презентации
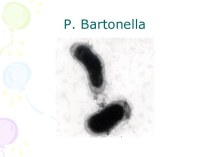
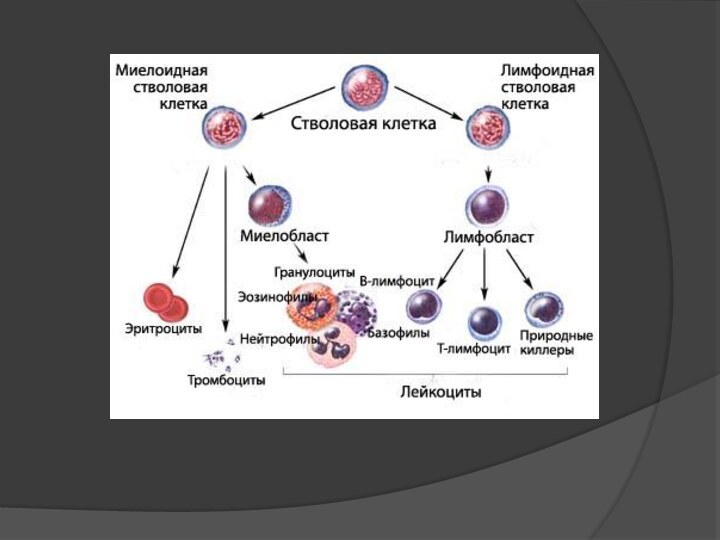
ОпределениеЛейкоз (лейкемия, алейкемия, белокровие, неправильно «рак крови») — клональное злокачественное (неопластическое) заболевание кроветворной системы. К лейкозам относится обширная группа заболеваний, различных по своей этиологии. При лейкозах злокачественный клон может происходить как из незрелых гемопоэтических клеток костного мозга, так и из созревающих и зрелых клеток крови.
























Слайд 2
Определение
Лейкоз (лейкемия, алейкемия, белокровие, неправильно «рак крови») — клональное злокачественное (неопластическое) заболевание кроветворной
Слайд 3
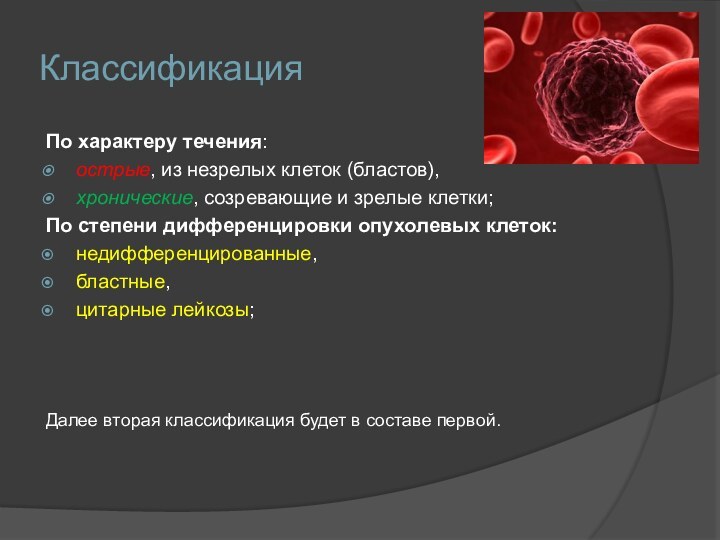
Классификация
По характеру течения:
острые, из незрелых клеток (бластов),
хронические, созревающие
и зрелые клетки;
По степени дифференцировки опухолевых клеток:
недифференцированные,
бластные,
цитарные лейкозы;
Далее вторая
классификация будет в составе первой.
Слайд 4
Классификация. Острых лейкозов.
Острый миелобластный лейкоз (М1)
Анализ костного мозга:
бластные клетки
составляют не менее 90%;
созревающие гранулоциты (все гранулоцитарные клетки
от промиелоцитов до сегментоядерных) составляют менее 10%. Острый миелобластный лейкоз с частичным созреванием (М2)
Костный мозг:
бластные клетки составляют не менее 30%, но менее 90%;
клетки моноцитарного ростка кроветворения составляют менее 20%;
созревающие гранулоциты составляют не менее 10%;
Острый промиелоцитарный лейкоз (М3)
Этот вариант устанавливают на основании типичного морфологического субстрата (характерного вида промиелоцитов в анализе костного мозга) без использования каких-либо дополнительных тестов.
Слайд 5
Классификация. Острых лейкозов.
Острый миеломонобластный лейкоз (М4)
Костный мозг:
клетки
миелоидного ростка кроветворения составляют не менее 30%, но менее
80%.Периферическая кровь:
клетки моноцитарного ростка кроветворения составляют не менее 5.0 х 10^9/л;
Острый монобластный лейкоз (М5)
Костный мозг:
клетки моноцитарного ряда гемопоэза составляют не менее 80%.
Острый мегакариобластный лейкоз (М7)
диагноз устанавливают на основании данных электронно-микроскопического исследования бластных клеток или на основании данных иммунофенотипирования.
Острый ранний миелобластный лейкоз (М0)
диагноз устанавливают на основании отрицательных результатов всех цитохимических окрасок бластных клеток или на основании данных иммунофенотипирования.
Слайд 6
Этиология. Химическая теория.
Согласно ей в организме образуются
эндогенно или проникают извне вещества — так называемые канцерогенные
(лейкозогенные) углеводороды. Экспериментально модели лейкозов удается воспроизвести у мышей введением им либо липоидных экстрактов из печени людей, умерших от лейкоза, либо канцерогенных углеводородов (например, 1, 2, 5, 6-дибензантрацен, 9, 10-диметил-1, 2-бензантрацен, 1, 2-бензпирен и метилхолантрен). Имеются указания на то, что чувствительность мышей к лейкозу повышается при нарушении баланса гормонов (после введения избытка эстрогенных гормонов, удаления надпочечников).
Слайд 7
Этиология. Вирусная теория.
На протяжении ряда лет в различных
странах ведутся работы по изучению роли вируса в развитии
Л. у человека. Результатом этих исследований явилось воспроизведение экспериментального лейкоза материалом, полученным от больного Л. человека. Однако фактическая сторона этих работ не является безупречной. Неясно, какое содержание вкладывается в понятие «лейкозный вирус», попадает ли он в организм извне или происходит эндогенно. В последнее время вирусные частицы обнаружены в плазме крови и культуре костного мозга людей, больных лейкозом. Бениш-Мельник, Смит подвергали ультрацентрифугированию плазму крови детей, больных лейкозом; электронномикроскопическое исследование осадка выявило наличие вирусных частиц, в то время как в аналогично приготовленном осадке плазмы здоровых детей таких частиц обнаружено не было. Вирусные частицы были также обнаружены в культуре ткани лейкозного костного мозга, и их не было в культуре нормального костного мозга. Возможно, что эти единичные исследования, проведенные на высоком методическом уровне, с соблюдением соответствующего контроля, и указывают на присутствие вирусного агента в тканях больных лейкозом, однако этиологическая роль этого фактора остается неясной. Клинические наблюдения также не дают оснований предполагать возможность контактной передачи Л. Это позволяет отрицать процесс эпидемиологии Л. в плане закономерностей, свойственных инфекционным заболеваниям.
Слайд 8
Этиология. Теория ионизирующей радиации.
Ряд авторов указывают на
причинную зависимость развития Л. от воздействия рентгеновых лучей. Имеются
многочисленные случаи развития лейкоза у пострадавших от взрыва атомных бомб в Хиросиме и Нагасаки. В клинике наблюдаются больные злокачественными опухолями, у которых вслед за лучевой терапией развивается Л. Чаще это происходит не ранее чем через 2—3 года. Однако патогенез радиационного лейкоза остается неясным. По Н. А. Краевскому, лучевое воздействие, приводящее всегда к депрессии кроветворения, служит предпосылкой для формирования процесса бурной пролиферации. В этом, по-видимому, и заключается сущность мутагенного действия лучевой радиации. При хронической гипопластической анемии у отдельных больных спустя несколько лет от начала заболевания происходит трансформация кроветворения по типу Л. Такое же явление наблюдалось у двух больных гипопластической анемией через 3—7 лет после спленэктомии. Таким образом, не только лучевая радиация, но и другие факторы могут служить поводом к такой трансформации.
Слайд 9
Патогенез 1/2.
Однако, вернёмся к острым лейкозам.
В основе патогенеза
острых лейкозов лежит мутация стволовой клетки крови, что влечет
за собой практически полную потерю потомками мутировавшей клетки способности к созреванию. Мутантный клон автономен от каких-либо регулирующих воздействий организма и достаточно быстро вытесняет нормальные гемопоэтические клетки, замещая собой весь гемопоэз.С момента мутации до момента появления клинических и лабораторных признаков заболевания проходит в среднем 2 месяца. За этот период времени количество опухолевых клеток увеличивается с 1 (родоначальница мутантного клона) до 10^9 -- 10^12. Масса такого количества клеток составляет около одного килограмма. Вытеснение нормальных гемопоэтических клеток, и замещение их опухолевыми клетками, неспособными к созреванию, закономерно приводит к уменьшению в периферической крови зрелых клеток с развитием анемии, гранулоцитопении, лимфопении, моноцитопении и тромбоцитопении, что будет проявляться соответствующей клинической картиной.
Слайд 10
Патогенез 2/2.
Уменьшение количества эритроцитов влечет за собой развитие
анемического синдрома. Уменьшение или полное исчезновение зрелых гранулоцитов, приводит
к развитию иммунодефицита и инфекционных осложнений. Свой вклад в патогенез инфекционных осложнений вносят также лимфопения и моноцитопения. Тромбоцитопения лежит в основе кровоизлияний и кровотечений.В ряде случаев опухолевые клетки не нуждаются в строго необходимом для нормальных гемопоэтических клеток стромальном микроокружении. Они могут покидать костный мозг и образовывать колонии опухолевого гемопоэза в других органах и тканях (селезенке, лимфоузлах, печени, центральной нервной системе, легких, коже, слизистых оболочках). Инфильтрация опухолевыми клетками органов и тканей относят к проявлениям пролиферативного синдрома. Степень злокачественности опухолевых клеток при остром лейкозе с течением времени возрастает (как и для других групп опухолей, для острых лейкозов правомочен закон опухолевой прогрессии). Поскольку опухолевые клетки при острых лейкозах, в большинстве вариантов, изначально имеют выраженный дефект созревания, то большая злокачественность часто проявляется появлением экстрамедуллярных очагов кроветворения, увеличением пролиферативной активности, развитием резистентности к проводимой терапии. В основе озлокачествления лежат вторичные мутации в опухолевых клетках. Это наглядно демонстрируют результаты цитогенетического исследования, выявляющего на ряду с изменениями хромосом, имевшими место в начале заболевания, появление дополнительных поломок по мере течения заболевания.
Слайд 11
Клинические проявления.
Клинические проявления одинаковы для всех вариантов
острых лейкозов и могут быть довольно полиморфными. Начало заболевания
может быть внезапным или постепенным. Для них не существует характерного начала, каких-либо специфических клинических признаков. Только тщательный анализ клинической картины позволяет распознать скрывающееся под видом «банального» заболевания более серьёзное.Характерна комбинация синдромов недостаточности костного мозга и признаков специфического поражения.
В связи с лейкозной инфильтрацией слизистых оболочек полости рта и ткани миндалин появляются некротический гингивит, тонзиллит (некротическая ангина). Иногда присоединяется вторичная инфекция и развивается сепсис, приводящий к смерти.
Тяжесть состояния больного может быть обусловлена выраженной интоксикацией, геморрагическим синдромом, дыхательной недостаточностью (вследствие сдавления дыхательных путей увеличенными внутригрудными лимфатическими узлами).
Использование активной цитостатической терапии повлияло на течение острых лейкозов, то есть привело к индуцированному лекарственному патоморфозу. В связи с этим в настоящее время выделяют следующие клинические стадии заболевания:
первая атака,
ремиссия (полная или неполная),
рецидив (первый, повторный).
Слайд 12
Диагностика острых лейкозов
Для постановки диагноза «острый лейкоз» необходима
чёткая морфологическая верификация - обнаружение несомненно бластных клеток в
красном костном мозге. Для диагностики острого лейкоза безусловно обязательно установление классической структуры ядра бластных клеток.
Слайд 13
Хронические лейкозы.
Хронические лейкозы отличаются от острых дифференцировкой опухолевых клеток и более
длительным стадийным течением.
Первая стадия (моноклоновая, доброкачественная) заболевания характеризуется присутствием одного
клона опухолевых клеток, течет годами, относительно доброкачественно, хронически.Вторая стадия (злокачественная) обусловлена появлением вторичных опухолевых клонов, характеризуется быстрым, злокачественным течением с появлением множества бластов и называется злокачественной, поликлоновой стадией, или стадией бластного криза. 80% больных хроническими лейкозами погибают в стадии бластного криза.
Хронические лейкозы включают в себя:
хронические лимфоцитарные лейкозы,
хронические миелоцитарные лейкозы.
Необходимо отметить, что острый лейкоз никогда не переходит в хронический, а хронический никогда не обостряется — таким образом, термины «острый» и «хронический» используются только из-за удобства.
Слайд 15
Хронический лимфоцитарный лейкоз (ХЛЛ).
- это доброкачественная опухоль из
лимфоидной ткани, основу которой составляют морфологически зрелые лимфоциты. Начало
заболевания обычно бессимптомное; во многих случаях хронический лимфолейкоз обнаруживается совершенно случайно, когда человек проходит обследование для диагностики других заболеваний.Причины заболевания не ясны. Предполагается, что на возникновение ХЛЛ влияние оказывает наследственность. Лейкозом заболевают при злокачественном перерождении клеток, проникающих в костный мозг и кровь.
При хроническом лимфолейкозе самостоятельно человек ничем не может себе помочь.
Слайд 17
Хронический миелоцитарный лейкоз (ХМЛ).
— хронический лейкоз, при котором
образуются опухолевые клетки типа процитарных и цитарных предшественников миелоидного
ряда.Фазы:
хроническая,
фаза акселерации,
фаза бластного криза.
В хроническую фазу самочувствие больного, как правило, достаточно хорошее, лечение в этой фазе имеет самый хороший прогноз.
В фазу акселерации у больного появляются новые генетические поломки, растут печень и селезенка, может повышаться температура тела, снижается гемоглобин, увеличивается количество тромбоцитов и лейкоцитов.
Слайд 19
Патогенез.
На уровне предшественника В-клетки происходит хромосомная аберрация, приводящая
к трисомии хромосомы 12 либо к структурным нарушениям хромосом
6, 11, 13 или 14. Патологические клетки дифференцируются до уровня рециркулирующих В-клеток или В-клеток памяти. Их нормальные клеточные аналоги — длительноживущие, иммунологически аре-активные, митотически пассивные В-клетки Т-независимого пути диффе-ренцировки и В-клетки памяти соответственно. Последующие деления генетически нестабильных лимфоцитов могут привести к появлению новых мутаций и соответственно новых биологических свойств, т.е. субклонов лейкозных клеток.
Слайд 21
Лабораторные методы исследования всех лейкозов.
Пункция костного мозга -
основной метод исследования при лейкозах. Его применяют с целью
подтверждения диагноза и идентификации (морфологической, иммунофенотипической, цитогенетической) типа лейкоза.Исследование ликвора. Повышенный цитоз за счёт бластов – явный признак лейкоза.
Биохимический анализ крови.
УЗИ: увеличение печени и селезёнки, очаги лейкемоидной инфильтрации в паренхиматозных органах.
Слайд 22
Дополнительные методы исследования.
Рентгенологическое исследование органов грудной клетки: расширение
тени средостения за счёт увеличения внутригрудных лимфатических узлов.
ЭКГ, эхокардиография,
ЭЭГ как и биохимия необходимы для определения исходных показателей функций жизненно важных органов и проводятся перед началом и во время химиотерапии, поскольку применяемые цитостатики обладают кардиотоксичными, гепатотоксичными и нефротоксичными свойствами.
Слайд 23
Лечение острых лейкозов.
В соответствии с современными представлениями программа
лечения острого лейкоза включает два этапа:
Индукция ремиссии.
Индукционная терапия -
химиотерапия, направленная на максимальное уничтожение лейкозных клеток, с целью достижения полной ремиссии.Химиотерапия после достижения ремиссии. Химиотерапия после достижения ремиссии обеспечивает предупреждение рецидива острого лейкоза.
На этом этапе лечения могут быть использованы различные подходы: консолидация, интенсификация и поддерживающая терапия.
Консолидация используется после достижения полной ремиссии и проводится по тем же программам, которые применялись при индукции ремиссии.
Интенсификация предполагает применение более активной химиотерапии, чем при индукции ремиссии.
Поддерживающая терапия предполагает использование химиотерапевтических препаратов в дозах меньших по сравнению с этапом индукции, но в течение более длительного периода времени.
Слайд 24
Лечение хронических лейкозов.
Существует три основных способа:
Назначение цитостатиков -
лекарств, подавляющих рост опухолевых клеток. Однако они оказывают влияние
и на здоровые клетки организма человека, поэтому их применяют в исключительных случаях.Лечение кортикостероидами. Происходит быстрое, но кратковременное улучшение состояния больного. При лечении кортикостероидами возникают различные проблемы: длительный прием лекарств вызывает осложнения, связанные с нарушениями обмена веществ, часто возникают различные инфекции.
Облучение увеличенных лимфоузлов, печени и селезенки. К сожалению, все три возможных метода лечения не гарантируют полного выздоровления больного лейкозом.
Слайд 25
Другие подходы в лечении лейкозов.
Высокодозная химиотерапия с последующей
трансплантацией стволовых кроветворных клеток (аутологичных или аллогенных).
Трансфузии лимфоцитов донора
Немиелоаблативная
трансплантация стволовых кроветворных клетокНовые лекарственные препараты (нуклеозидные аналоги, дифференцирующие средства, моноклональные антитела).
Слайд 26
Реабилитация. Диспансерное наблюдение.
Реабилитация заключается в обеспечении полного покоя,
минимизации физических нагрузок и соблюдении специализированных диет. После завершения
лечения лейкоза человеку не следует переезжать в места с отличающимися климатическими показателями или подвергать свой организм любым процедурам, связанным с физиотерапией. Детям, которые переболели лейкозом, важно делать профилактические прививки в соответствии со специально разработанным врачами графиком.Наблюдение в условиях диспансера сводится к постоянному проведению биохимическому анализу крови, ЭКГ, эхокардиографии, ЭЭГ и контроле остальных показателей организма. (Контроль токсичного действия лекарственных средств.)