Слайд 2
Цель лекции: Систематизировать современные представления
об основных формах эндокринопатий, причинах и механизмах их развития.
Содержание лекции:
Типы структуры нейроэндокринной системы;
Образование гормонов, их транспорт и виды действия на клетки-мишени;
Механизмы гашения гормонального сигнала;
Этиопатогенез основных форм эндокринопатий;
Регуляторные пептиды;
Виды апудопатий, их примеры;
Адаптация и стресс;
Механизмы адаптационного синдрома;
Стресс-лимитирующие системы.
Слайд 3
Классификация гормонов по химическому строению
производные аминокислот (Т3,Т4, адреналин, норадреналин);
стероиды
(гормоны коры надпочечников и половых желез);
пептиды и белки (инсулин, тропные гормоны гипофиза и др.);
простагландины
Слайд 4
Типы структуры нейроэндокринной системы
I - (церебропитуитарный) включает
пять звеньев: кора► подкорка (гипоталамус)► гипофиз (тропные гормоны)► периферическая
железа ► периферические клетки-мишени. Нейросекреторные клетки гипоталамуса занимают промежуточное положение между нервными и эндокринными, а их нейросекреты — между медиаторами и гормонами.
II — гипофизнезависимый Отсутствует промежуточное аденогипофизарное звено регуляции и последняя осуществляется парагипофизарно, главным образом, через секреторное, сосудистое и трофическое влияние нервной системы на периферические железы.
Слайд 5
Этапы образования и превращения гормона
Биосинтез гормона;
Секреция, т.е. выделение
из эндокринной клетки;
Транспорт кровью к периферическим тканям;
Распознавание гормонального сигнала
клетками-мишенями;
Трансдукция (перевод) гормонального сигнала в биологический ответ;
Гашение гормонального сигнала.
Слайд 6
Транспорт гормонов
Большинство гормонов образуют
комплексные соединения с белками плазмы.
Часть белков специфические транспортные протеины (транскортин), часть неспецифические (γ -глобулины). Часть гормонов связана в крови с эритроцитами.
Значение образования связанных форм:
Предохраняет организм от избыточного накопления в крови (и влияния на ткани) свободных гормонов;
Связанная форма гормона является его физиологическим резервом;
Связывание с белками защищает гормон от разрушения ферментами;
Комплексирование с белками препятствует фильтрации мелкомолекулярных гормонов через почечные клубочки.
Слайд 7
Виды действия гормонов на ткани- мишени
Метаболическое действие;
Морфогенетическое действие
– влияние на процессы формообразования, дифференцировки и роста структурных
элементов;
Кинетическое действие – способность гормона запускать деятельность эффектора, включать реализацию определенной функции (окситоцин →сокращение мускулатуры матки);
Корригирующее действие- изменение деятельности органов или процессов, которые происходят и в отсутствии гормона (адреналин → ЧСС);
Реактогенное действие – способность менять реактивность ткани к действию того же гормона, других гормонов или медиаторов (Т3,Т4 усиливают эффекты катехоламинов).
Слайд 8
Механизмы гашения гормонального сигнала
↓ биосинтетической и секреторной активности
самих гормон-продуцирующих клеток;
Разрушение (катаболизм) части выделенных гомонов;
Инактивация гормонов путем
дезаминирования и метилирования в печени (в процессе инактивации связываются с глюкуроновой кислотой→ ↑водорастворимость и выделение через почки);
Часть гормонов поступает в желчь и выводится через кишечник;
Образуются ингибиторы и антитела тормозящие эффект;
↓ активности гормонального сигнала достигается в результате секреции контррегуляторных гормонов;
Десенситизация тканей при длительно повышенном уровне гормона в крови;
Торможение секреции по принципу обратной связи.
Слайд 9
Этиопатогенез основных форм эндокринопатий
Три основных
патогенетических варианта эндокринопатий:
нарушения центральной регуляции функций периферических эндокринных
желез;
первичные нарушения гормонообразования в периферических железах;
внежелезистые нарушения (транспорта, рецепции гормонов, пострецепторных процессов и др.).
Слайд 10
Нарушения центральной регуляции
Могут быть вызваны механическими повреждениями,
воспалением, расстройствами кровообращения, опухолями и другими неспецифическими патогенными воздействиями,
которые вовлекают в патологический процесс и кору больших полушарий и подкорковые структуры.
Специфическими для кортикального генеза эндокринных нарушений являются расстройства ВНД в виде психозов, неврозов, нервно-психических стрессорных состояний различного рода.
Слайд 11
Первичные нарушения функции периферических эндокринных желез
Повреждения желез опухолью.
Могут быть обусловлены врожденными дефектами развития желез или их
атрофией может быть вызвана склеротическим процессом, хроническим воспалением, возрастной инволюцией, длительным лечением экзогенными гормонами, гормонально-активной опухолью парной железы. В основе повреждения и атрофии железы могут лежать аутоиммунные процессы.
Инфекции
Образование гормонов может быть нарушено
- в связи с наследственными дефектами ферментов, необходимых для их синтеза, или инактивацией (блокадой) их.
- в связи с дефицитом субстратов, входящих в их состав (например, йода).
Причиной эндокринопатии может быть истощение биосинтеза гормонов в результате длительной стимуляции желез и ее гиперфункции.
Слайд 12
Внежелезистые формы эндокринных расстройств
При ↓↑ способности белков
плазмы связывать гормоны;
Инактивация циркулирующих гормонов;
Нарушения рецепции гормона
в клетках-мишенях (на поверхности или внутри клетки). Следствие генетически обусловленного отсутствия или малочисленности рецепторов, дефекта их структуры, конкурентной блокады рецепторов «антигормонами» и др.
Антитела могут быть направлены к различным частям рецептора и вызывать разные нарушения: блокировать механизм «узнавания» гормона; связываться с активным центром рецептора и имитировать гиперфункцию железы; приводить к образованию комплексов «рецептор-антитело», активирующих факторы системы комплемента, повреждающих рецептор;
Нарушения пермиссивного «посреднического» действия гормонов (Т4-СТГ);
Нарушения метаболизма гормонов (гепатит, гепатоз).
Слайд 13
!!!!
Причины и механизмы эндокринных расстройств отличаются
очень большим разнообразием.
Далеко не
всегда в основе этих расстройств лежит недостаточная или избыточная продукция соответствующих гормонов, но всегда неадекватность их периферических эффектов в клетках-мишенях, приводящая к сложному переплетению метаболических, структурных и физиологических нарушений.
Слайд 14
Регуляторные пептиды
Это биологически активные вещества, синтезируемые различными по
происхождению клетками организма и участвующие в регуляции различных функций.
В
онтогенезе регуляторные пептиды появились значительно раньше «классических» гормонов, т.е. до обособления специализированных эндокринных желез.
Источником регуляторных пептидов служат одиночные гормон-продуцирующие клетки, образующие иногда небольшие скопления.
Слайд 15
Синаптические механизмы действия пептидов
Выражаются в нейромедиаторной или нейромодуляторной функции
Некоторые пептиды выполняют функцию нейротрансмиттера через пептидергические рецепторы, имеющиеся на нейронах. В отличие от «классических» нейротрансмиттеров (НА, серотонина, допамина) пептиды характеризуются высокой аффинностью рецепторов и продолжительным действием в связи с отсутствием ферментных систем инактивации и обратного депонирования.
Нейромодулятор не вызывает самостоятельного физиологического эффекта на постсинаптической мембране, но модифицирует реакцию клетки на нейромедиатор.
Слайд 16
Внесинаптическое действие пептидов
1. Паракринное действие → осуществляется
в зонах межклеточного контакта (соматостатин, выделяемый поджелудочной железой выполняет
паракринную функцию в контроле секреции инсулина и глюкагона β- и α-клетками железы) .
2. Нейроэндокринное действие → через выделение пептида в кровяное русло и его влияние на клетку-эффектор (соматостатин гипоталамуса).
3. Эндокринное действие → Пептиды выделяются в кровоток и действуют как дистантные регуляторы (установлено наличие обособленных рецепторов).
Слайд 17
Функции регуляторных пептидов
1. Боль. Влияют на формирование
боли как сложного психофизиологического состояния организма (субстанция Р, соматостатин,
ВИП и др).
2. Память, обучение, поведение. Установлено влияние пептидов на пищевое поведение. ВИП оказывает снотворное, гипотензивное и бронхолитическое действие. Опиоидные пептиды влияют на эмоциональные реакции.
3. Вегетативные функции. Многие участвуют в контроле уровня АД (ВИП, кальцитонин, атриопептид).
4. Стресс. Ряд нейропептидов (опиоидные, пролактин, пептиды эпифиза) относят к антистрессорной системе (ограничивают развитие стресса).
5. Влияние на иммунную систему. Доказана способность пептидов модулировать иммунные ответы.
Слайд 18
«APUD- система»
Е. Пирс (1976) обосновал теорию существования в
организме специализированной нейроэндокринной клеточной системы (APUD-системы). Входящие в нее
клетки → апудоциты.
По характеру функций БАВ системы делят на:
- соединения, выполняющие строго определенные конкретные функции (инсулин, глюкагон, АКТГ, СТГ, мелатонин и др.);
- соединения с многообразными функциями (серотонин, катехоламины и др.).
При патологии развивается симптоматика эндокринного заболевания, соответствующая профилю секретируемых гормонов.
Слайд 19
Виды апудопатий
Апудопатии – заболевания, связанные
с нарушением структуры и функции апудоцитов и выражающиеся в
определенных клинических синдромах.
Различают:
По происхождению: первичные и вторичные;
По распространенности: множественные и солитарные;
По функциональному признаку: гипер-,гипо и дисфункциональные формы (при множественных апудопатиях).
Слайд 20
Гастринома
Апудома из клеток, продуцирующих
гастрин (чаще локализуется в поджелудочной железе, а также в
ДПК), который стимулирует выделение большого количества желудочного сока с высокой кислотностью и переваривающей силой.
Проявляется развитием ульцерогенного синдрома Золлингера –Эллисона (быстроразвивающееся язвенное поражение, чаще ДПК, боли в эпигастрии, язвенные кровотечения).
Слайд 21
Примеры АПУДом
Кортикотропинома – апудома, развивающаяся из апудобластов ЖКТ
и проявляющаяся эктопической гиперпродукцией АКТГ и развитием синдрома Иценко-Кушинга.
ВИПома-
опухоль из клеток, секретирующих вазоактивный интестинальный пептид. Локализуется в ДПК или поджелудочной железе. Проявляется развитием водной диареи и обезвоживанием, а также расстройством обмена электролитов (синдром Вернера-Моррисона или эндокринная холера).
Слайд 22
Примеры АПУДом
Соматостатинома – опухоль из
клеток кишечника или островковой ткани поджелудочной железы, продуцирующих соматостатин.
Характеризуется клиническим синдромом, включающим сахарный диабет, желчекаменную болезнь, гипохлоргидрию, стеаторею, анемию.
Дигностируется по ↑ концентрации соматостатина в плазме крови.
Слайд 23
Примеры АПУДом
Глюкагеномы (>100) –
злокачественные гормональноактивные опухоли, локализующиеся преимущественно в хвосте поджелудочной железы.
Глюкагенома приводит к развитию диабетическо-дерматитного синдрома признаки умеренно выраженного сахарного диабета (вследствие гиперглюкагонемии) и изменения кожи в виде мигрирующей некролитической эритемы. Развивается глоссит, стоматит, анемия, похудание.
У детей нередки судороги, периодами апноэ, иногда коматозное состояние.
Слайд 24
Адаптация
Адаптационный процесс – общая реакция организма на действие
чрезвычайного для него фактора внешней или внутренней среды, характеризующаяся
стадийными специфическими и неспецифическими изменениями жизнедеятельности, обеспечивающая повышение резистентности организма к воздействующему на него фактору и как следствие – приспособляемости его к меняющимся условиям существования.
Слайд 25
Стресс
Это генерализованная неспецифическая реакция организма, возникающая под действием
различных факторов необычного характера, силы и / или длительности.
Стресс
предшествует развитию стадии устойчивой резистентности адаптационного синдрома и является важным фактором, вызывающим формирование этой стадии.
Стресс- реакция является обязательным звеном механизма срочной адаптации организма к действию любого чрезвычайного фактора.
Слайд 26
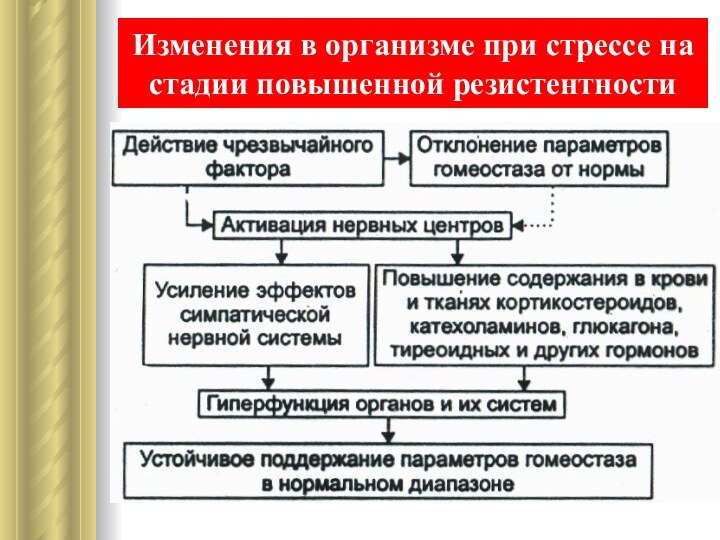
Общий механизм адаптационного синдрома на стадии повышенной устойчивости
Слайд 27
Изменения в организме при стрессе на стадии повышенной
резистентности
Слайд 28
Изменения в организме при стрессе на стадии истощения