- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основи трансплантаційного імунітету. Автоімунної хвороби та імунологія пухлин
Содержание
- 2. Иммунная толлерантность – естественная толерантность иммунной системы
- 3. ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ (ГКГС)
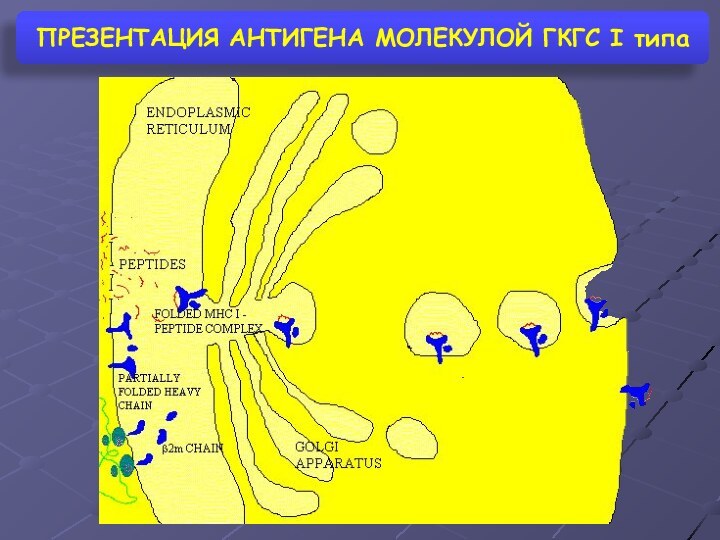
- 4. ПРЕЗЕНТАЦИЯ АНТИГЕНА МОЛЕКУЛОЙ ГКГС I типа
- 5. СЕЛЕКЦИЯ Т-ЛЦ В ТИМУСЕПре –тимоцитТимич.эпителиальная клеткаMHC-молекулаДендритАутоантигенБез
- 6. ТРАНСПЛАНТАЦИОННЫЙ ИММУНИТЕТ- это реактивность иммунокомпетентных клеток, направленная
- 7. ДЕФИНИЦИИТрансплантационные антигены - расположены на поверхности любых
- 8. ВИДЫ ТРАНСПЛАНТАЦИИ АУТОТРАНСПЛАНТАТ - собственная ткань
- 9. РАЗВИТИЕ ИММУНОЛОГИИ ДО СЕРЕДИНЫ ХХ ВЕКАКарл Ла́ндштейнер
- 10. НОВЕЙШАЯ ИММУНОЛОГИИБарух Бенасерраф 1920 г.г., Жан Доссе
- 11. ИСТОРИЯ ТРАНСПЛАНТОЛОГИИА. Каррель в 1902 г. выполнил
- 12. Вероятность найти полностью совместимого донора с реципиентом
- 13. 1. Подбор (селекция) пары донорреципиент по антигенам
- 14. 1. Диагностика реакции отторжения 2. Контроль адекватности и эффективности иммуносупрессии 3. Диагностика инфекционных осложнений ПОСТРАНСПЛАНТАЦИОННЫЙ МОНИТОРИНГ
- 15. Стадии трансплантационного иммунитета: Распознавания чужеродного трансплантата (осуществляется
- 16. ПРЯМОЕ И НЕПРЯМОЕ РАСПОЗНАВАНИЕ МОЛЕКУЛ MHC
- 17. КЛЕТОЧНЫЕ МЕХАНИЗМЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА1 - цитолиз, осуществляемый
- 18. ГУМОРАЛЬНЫЕ МЕХАНИЗМЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТААнтитела могут привлекать макрофаги
- 19. КЛЕТОЧНЫЕ МЕХАНИЗМЫ РЕАКЦИИ ≪ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА≫В
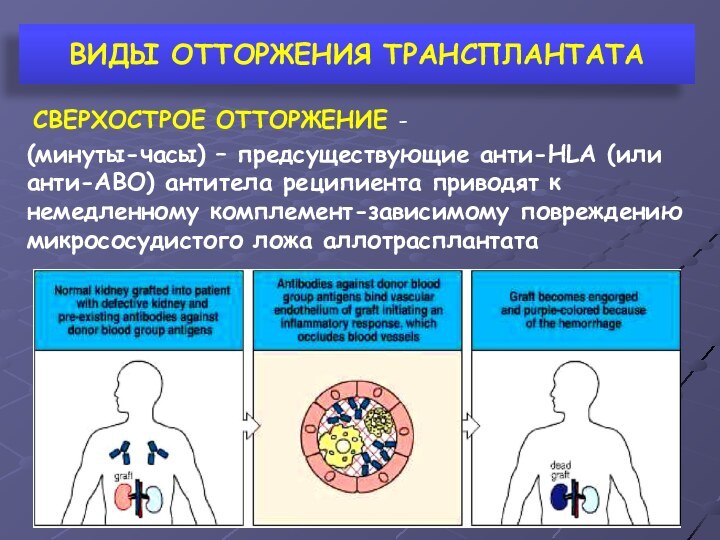
- 20. ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА СВЕРХОСТРОЕ ОТТОРЖЕНИЕ - через
- 21. ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА СВЕРХОСТРОЕ ОТТОРЖЕНИЕ - (минуты-часы)
- 22. ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТАОСТРОЕ РАННЕЕ ОТТОРЖЕНИЕ - «классическая»
- 23. ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТАОТСРОЧЕННОЕ ГУМОРАЛЬНОЕ ОТТОРЖЕНИЕ – -Концентрация
- 24. Подбор совместимой пары донор-реципиент (типирование тканей по
- 25. Аутоиммунные болезни – патологический процесс с выработкой аутоантител и активизацией клеточной аутореактивности
- 26. КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА АУТОИММУННЫХ БОЛЕЗНЕЙ Основа - аутоиммунная
- 27. ТЕОРИИ РАЗВИТИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙНАИБОЛЕЕ УБЕДИТЕЛЬНЫЕТеория "запретных" клонов
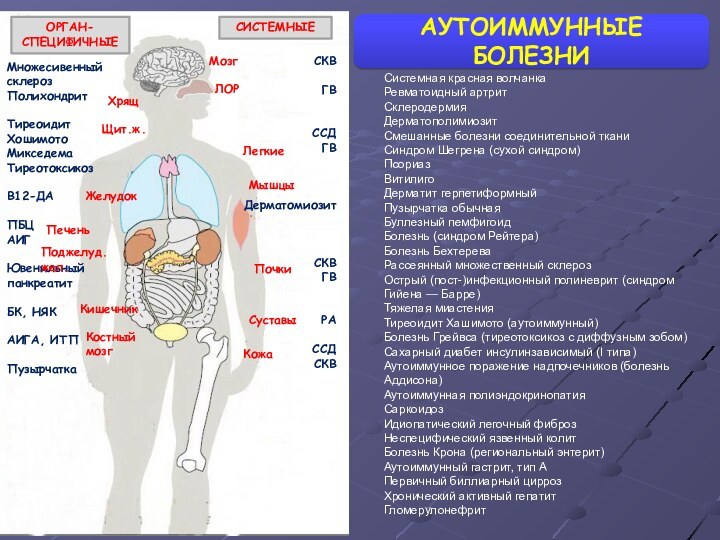
- 28. АУТОИММУННЫЕ БОЛЕЗНИМножесивенный склерозПолихондритТиреоидит ХошимотоМикседемаТиреотоксикозВ12-ДАПБЦАИГЮвенильный панкреатитБК, НЯКАИГА, ИТППузырчаткаОРГАН-СПЕЦИФИЧНЫЕСИСТЕМНЫЕСКВГВССДГВДерматомиозитСКВГВРАССДСКВМозгХрящЩит.ж.ЛОРЖелудокЛегкиеМышцыПеченьПочкиКишечникПоджелуд.жел.Костный
- 29. РАЗЛИЧИЯ МЕЖДУ ОРГАНОСПЕЦИФИЧЕСКИМИ И СИСТЕМНЫМИ АИЗ
- 30. МЕХАНИЗМЫ РАЗВИТИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ
- 31. ПРИЧИНЫ НАРУШЕНИЯ АУТОТОЛЕРАНТНОСТИНарушение процессов отрицательной селекции, повышающее
- 32. МЕХАНИЗМЫ ИНДУКЦИИ АУТОИММУННЫХ ПРОЦЕССОВповреждение барьеровэкстраординарная экспрессия костимулирующих молекулABCDмодификация аутоантигенаантигенная мимикрия
- 33. ГЕНЕТИЧЕСКИ ДЕТЕРМИНИРОВАННЫЕ АУТОИММУННЫЕ МЕХАНИЗМЫАутоиммунные процессы, вызванные мутацией гена AIREПоследствия мутации генов, контролирующих факторы рецепторного апоптозаАВ
- 34. АССОЦИАЦИИ МЕЖДУ АУТОИММУННЫМИ БОЛЕЗНЯМИ И СИСТЕМОЙ HLA
- 35. НЕДОСТАТОЧНОСТЬ РЕГУЛЯТОРНЫХ Т-КЛЕТОКДефицит регуляторных Т-лимфоцитов, вызванный мутацией
- 36. НАРУШЕНИЕ ПЕРИФЕРИЧЕСКОЙ АУТОТОЛЕРАНТНОСТИГомеостатическая пролиферация Т-лимфоцитов как основа
- 37. ТКАНИ-МИШЕНИ ДЛЯ ОБРАЗОВАНИЯ АУТОАНТИТЕЛ
- 38. ИММУНОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ Типы реакций гиперчувствительностиТип
- 39. РОЛЬ АНТИТЕЛ В ПАТОГЕНЕЗЕ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ
- 40. МЕХАНИЗМЫ ИНДУКЦИИ АУТОИММУННОЙ РЕАКЦИИТ-ЛЦ в стадии покояВирусСигналСигналАПКАнтигенный пептидИнсулоцитЦитотоксикностьАктивация Т-ЛЦ1. ИНДУКЦИИ АУТОИММУННОГО ОТВЕТА ПУТЕМ АКТИВАЦИИ Т-ЛЦ ВИРУСОМ
- 41. МЕХАНИЗМЫ ИНДУКЦИИ АУТОИММУННОЙ РЕАКЦИИАутоАГЧужерод.частьАутоАГ частьИммуноглобулинПроцессингАутоАТВ-ЛЦТ-ЛЦТ-ЛЦ рецепторHLA ІІ
- 42. ИММУННЫЕ МЕХАНИЗМЫ ВАСКУЛИТОВИММУННЫЕ ВАСКУЛИТЫ:аутоАТ ассоциированныеАНЦА: ГВ, микроскопический
- 43. ПАТОГЕНЕЗ ГРАНУЛЕМАТОЗА ВЕГЕНЕРА1. НЕАКТИВНЫЕ ЭК И ГРАНУЛОЦИТЫЭндотелиальные
- 44. ПАТОГЕНЕЗ РЕВМАТОИДНОГО АРТРИТАСиновиальная мембранаИнтра-артикулярное пространствоАлло- или ауто-
- 45. Принципы иммунной лабораторной диагностики АИЗ1. Определение специфических
- 46. ИММУНОЛОГИЯ ОПУХОЛЕЙФОРМЫ ВЗАИМОДЕЙСТВИЯ ИММУНИТЕТА И ОПУХОЛИОПУХОЛЕВЫЕ АНТИГЕНЫРАСПОЗНАВАНИЕ И ИДЕНТИФИКАЦИЯ ОПУХОЛЕВЫХ АНТИГЕНОВИММУННЫЙ "МЕХАНИЗМ УКЛОНЕНИЯ"СОВРЕМЕННАЯ ИММУНОТЕРАПИЯ ОПУХОЛЕЙ
- 47. ФОРМЫ ВЗАИМОДЕЙСТВИЯ ИММУНИТЕТА И ОПУХОЛИ
- 48. АНТИБЛАСТОМНЫЕ ИММУННЫЕ ФАКТОРЫКлеточные:Цитотоксические Т-лимфоцитыЕК- и К-клеткиАктивированные макрофагиГуморальные: Специфические антитела ИЛ-1 ИЛ-2 ФНО Интерферон
- 49. АТАКУЮЩИЕ NK-КЛЕТКИ И ЦТЛ
- 50. ПРОБЛАСТОМНЫЕ ИММУННЫЕ ФАКТОРЫПодавляют иммунитет:Супрессивные вещества -продукты ЛЦ
- 51. ОПУХОЛЬАССОЦИИРОВААННЫЕ АНТИГЕНЫОпухолеэмбриональные антигены
- 52. ПАТОГЕНЕЗ ОБРАЗОВАНИЕ ОНКОАНТИГЕНОВХромосомальные транслокацииТочки мутацийОбъединенный генОбъединенный пептид
- 53. ПАТОГЕНЕЗ ОБРАЗОВАНИЕ ОНКОАНТИГЕНОВПРОДУКЦИЯ НОРМАЛЬНОГО ГЕНАГИПЕРПРОДУКЦИЯ АНТИГЕНА ОПУХОЛЬЮЗдоровый
- 54. ФАКТОРЫ ИММУНОРЕЗИСТЕНТНОСТИ ОПУХОЛЕЙ Низкая иммуногенность онко АГ.Дисбаланс
- 55. МЕХАНИЗМ УСКОЛЬЗАНИЯ ОПУХОЛЕВЫХ КЛЕТОК ОТ РАСПОЗНАВАНИЯ ИММУННОЙ
- 56. ПРИНЦИПЫ ИММУНОТЕРАПИИ ОПУХОЛЕЙ
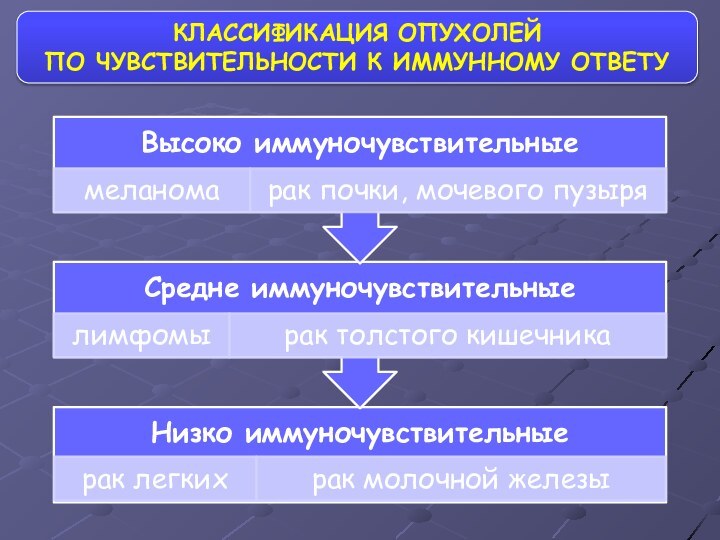
- 57. КЛАССИФИКАЦИЯ ОПУХОЛЕЙ ПО ЧУВСТВИТЕЛЬНОСТИ К ИММУННОМУ ОТВЕТУ
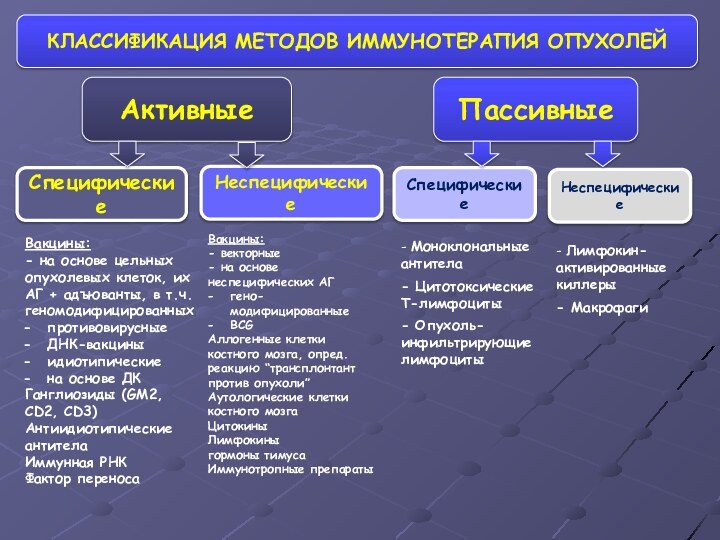
- 58. КЛАССИФИКАЦИЯ МЕТОДОВ ИММУНОТЕРАПИЯ ОПУХОЛЕЙАктивныеПассивныеСпецифическиеНеспецифическиеСпецифическиеНеспецифическиеВакцины:- на основе цельных
- 59. СОВРЕМЕННАЯ ИММУНОТЕРАПИЯ ОПУХОЛЕЙОПУХОЛИ С ДОКАЗАННЫМ ЭФФЕКТОМ ИММУНОТЕРАПИИ
- 60. СОВРЕМЕННАЯ ИММУНОТЕРАПИЯ ОПУХОЛЕЙ
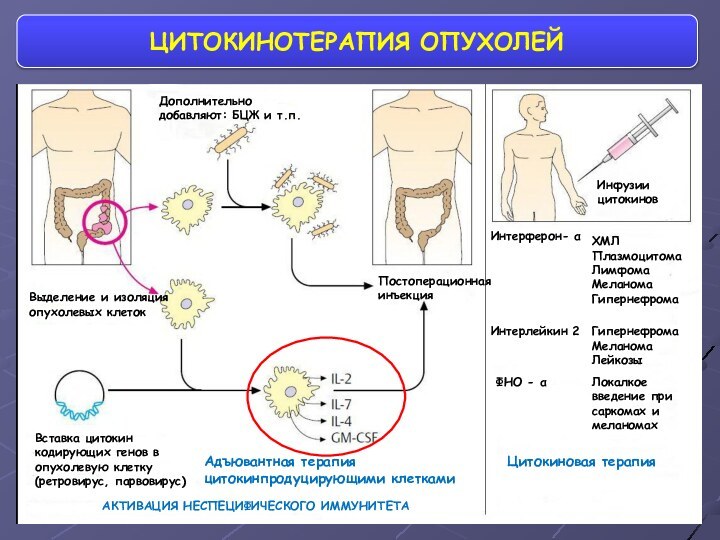
- 61. ЦИТОКИНОТЕРАПИЯ ОПУХОЛЕЙВставка цитокин кодирующих генов в опухолевую
- 62. ИНДУКЦИЯ Т-КЛЕТОЧНОГО ОТВЕТА НА ОПУХОЛЬВыделение и изоляция
- 63. ВАКЦИНЫ ИЗ ДЕНДРИТНЫХ КЛЕТОКАктивация и стимуляция пролиферации
- 64. Процедура получения дендритной вакцины2. Нагрузка незрелых ДК
- 65. ДНК-ВАКЦИНЫНе обладает вирулентностью Относительно легко и быстро
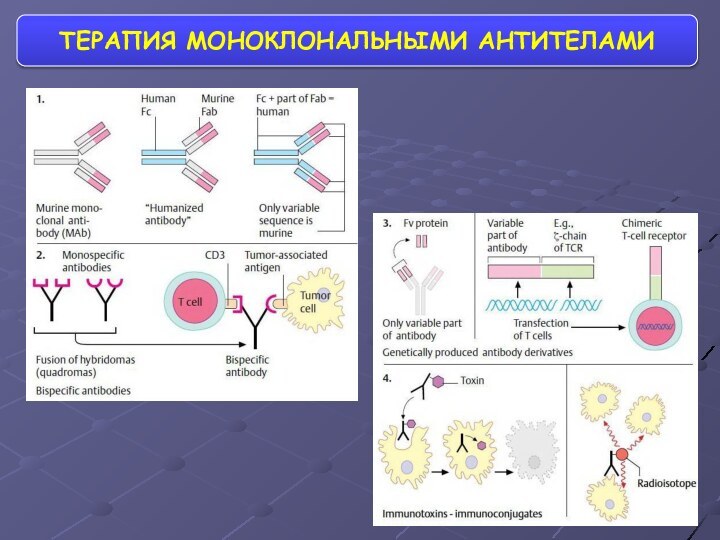
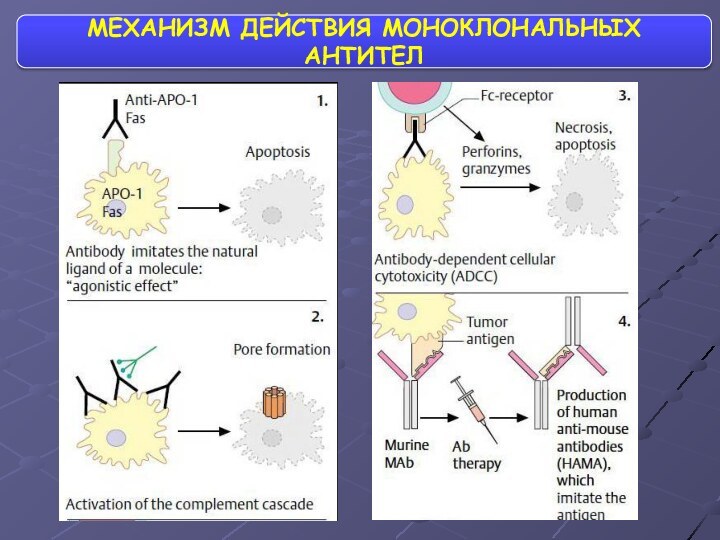
- 66. ТЕРАПИЯ МОНОКЛОНАЛЬНЫМИ АНТИТЕЛАМИ
- 67. Скачать презентацию
- 68. Похожие презентации























































Слайд 5
СЕЛЕКЦИЯ Т-ЛЦ
В ТИМУСЕ
Пре –
тимоцит
Тимич.
эпителиальная клетка
MHC-молекула
Дендрит
Аутоантиген
Без связи
Зрелый Т-ЛЦ
ТИМУС
СО ЗРЕЛЫМИ Т-ЛЦ
Тимоцит
Сцепление с МНС
Распознов.
аутоАГ
Прогноз
Гибель
Гибель
Гибель
Созревание
-
-
Нет
Да
Нет
Выражено
Умерен.
Умерен.
А
B
C
D
А
B
C
D
3-й этап созревания лимфоцитов
Разрушение (делеция)
аутореактивных Т- и В-ЛЦ с высокой активностьюИндукция аутореактивных Т- и В-ЛЦ в состоянии неактивности (негативная селекция)
Позитивная селекция – активация созревания ЛЦ с умеренной реакцией на АГ
Слайд 6
ТРАНСПЛАНТАЦИОННЫЙ ИММУНИТЕТ
- это реактивность иммунокомпетентных клеток, направленная против
чужеродных антигенов, находящихся на поверхностных мембранах клеток трансплантата, опухолевых
клеток, а также против нормальных собственных клеток, адсорбировавших вирусные и бактериальные антигены.- обеспечивает элиминацию из организма чужеродных в генетическом отношении клеточных элементов, а также собственных клеток, синтезирующих чужеродные вещества или адсорбировавших чужеродные антигены
Слайд 7
ДЕФИНИЦИИ
Трансплантационные антигены - расположены на поверхности любых ядросодержащих
клеток, строго контролируются генами гистосовместимости. У человека наибольшее их
количество содержится в лимфоидной ткани, селезенке, лимфоузлах, коже.Система трансплантационных антигенов (HLA), обеспечивает биологическую индивидуальность организма, осуществление иммунологического надзора, приводящего к повреждению, гибели и удалению из организма антигенно чужеродных клеток и тканей.
Слайд 8
ВИДЫ ТРАНСПЛАНТАЦИИ
АУТОТРАНСПЛАНТАТ - собственная ткань донора, пересаженная ему
же;
АЛЛОТРАНСПЛАНТАТ - (гомотрансплантат) - орган или ткань, пересаженные между
представителями одного и того же вида, имеющие разный генотип (трансплантация органа от одного человека - другому);КСЕНОТРАНСПЛАНТАТ- (гетеротрансплантат ) - орган или ткань, пересаженные в пределах двух разных видов (пересадка печени от свиньи - человеку ).
ИЗОТРАНСПЛАНТАЦИЯ — пересадка между идентичными близнецами или между генетически идентичными животными
Слайд 9
РАЗВИТИЕ ИММУНОЛОГИИ ДО СЕРЕДИНЫ ХХ ВЕКА
Карл Ла́ндштейнер 1868
– 1943 г.г.
открыл основы иммунологических процессов, направленных против
чужеродных тканейпоказал наличие генетически детерминированного полиморфизма на примере эритроцитов — он открыл группы крови системы АВ0 (1930г. Нобелевская премия)
Питер Б. Медавар 1915-1987 г.г.
доказал иммунологическую природу отторжения аллотрансплантатов
доказал, что главный фактор трансплантационного иммунитета лимфоциты, способные перенести эту форму иммунитета интактным реципиентам
Сэр Фрэнк М. Бёрнет 1899-1985 г.г.
автор клонально-селективной теории иммунитета
первооткрыватель явления иммунотолерантности
Слайд 10
НОВЕЙШАЯ ИММУНОЛОГИИ
Барух Бенасерраф 1920 г.г., Жан Доссе 1916-2009
г.г., Джордж Д. Снелл 1903-1996 г.г.
открыли генетические факторы,
определяющие тканевую совместимость при трансплантацииоткрыли и описали строение молекулы главного комплекса гистосовместимости
Джозеф Мюррей 1909-2003 г.г. и Эдуард Донналл Томас 1920-2012 г.г
провели первыми трансплантацию костного мозга, пересадку почки
исследовании механизма реакции отторжения трансплантата
Слайд 11
ИСТОРИЯ ТРАНСПЛАНТОЛОГИИ
А. Каррель в 1902 г. выполнил первую
трансплантацию почки животному, а в 1905 году - трансплантацию
сердца и разработал сосудистый шов.Ю.Ю.Воронной (г. Харьков) в 1933 г., впервые в мире осуществил пересадку трупной почки больной, страдавшей ОПН.
Лаурел (США) в 1950 г. и Шарль Дюбо (Франция) в 1951 г. успешно пересадили трупные почки. Успех операций был временным, так как не было эффективной супрессивной терапии.
Б.В.Петровский (Россия) в 1965 г. выполнил первую трансплантацию почки от живого донора.
Кристиан Барнард (ЮАР) в 1967 г. произвел 2 первые пересадки сердца. Первый больной прожил 17 дней, умер от пневмонии и реакции отторжения. Другой пациент прожил после операции два года.
В.И.Шумаков (Россия) в 1987 г. в Московском НИИ трансплантации органов и тканей произвел пересадку сердца.
Слайд 12 Вероятность найти полностью совместимого донора с реципиентом по
антигенам HLA составляет от 1:1000 до 1:1000000.
Вероятность подбора
полностью совместимого донора среди родных братьев и сестер составляет 1:4, так как гены HLA наследуются по законам Менделя. Гены HLA передаются потомству двумя блоками (гаплотипа HLA) — по одному от каждого родителя.
Совокупность антигенов HLA, представленных на поверхности клеток, составляет фенотип HLA, например A1, A24, B35, B44, Cw4, Cw5, DR6, DR7, DQ1, DQ2.
При совместимости донора и реципиента по антигенам HLA отторжение трансплантата можно предотвратить с помощью минимальной иммуносупрессивной терапии, необходимой для подавления иммунного ответа на слабые антигены гистосовместимости, не относящиеся к антигенам HLA.
ПОДБОР ДОНОРА
Слайд 13 1. Подбор (селекция) пары донорреципиент по антигенам гистосовместимости
системы НА
серологическое типирование (локусы
А,В,С, DR)
генное (ДНК)
типирование (полиморфные гены локусов , DQ), с помощью ПЦР и
специфичных праймеров.
2. Выявление предсуществующих лимфоцитотоксических антител против лимфоцитов донора или против панели клеток от неспецифических доноров (match reaction)
ПРЕТРАНСПЛАНТАЦИОННЫЙ МОНИТОРИНГ
Слайд 14
1. Диагностика реакции отторжения
2. Контроль адекватности и
эффективности иммуносупрессии
3. Диагностика инфекционных осложнений
ПОСТРАНСПЛАНТАЦИОННЫЙ МОНИТОРИНГ
Слайд 15
Стадии трансплантационного иммунитета:
Распознавания чужеродного трансплантата (осуществляется в
регионарных лимфоузлах, при контакте Т-лимфоцитов с антигенами трансплантата).
Иммунизации -
размножение клона ЦТТ-лимф (Т-киллеры), попадающих в кровоток и концентрирующихся в сосудах и тканях трансплантата. Разрушения - продукция медиаторов
Слайд 16 ПРЯМОЕ И НЕПРЯМОЕ РАСПОЗНАВАНИЕ МОЛЕКУЛ MHC ПРИ ТРАСНПЛАНТАЦИИ
ТКАНЕЙ
Прямое и непрямое распознавание молекул MHC при траснплантации тканей.
Клетки и молекулы донора и реципиента обозначены разными цветами. Прямое распознавание предполагает распознавание Т-клеткой реципиента целой молекулы MHC, непрямое — распознавание эпитопов донорской молекулы MHC в составе MHC хозяина
Слайд 17
КЛЕТОЧНЫЕ МЕХАНИЗМЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
1 - цитолиз, осуществляемый преимущественно
CD8+ и в меньшей степени CD4+ Т-клетками
2 -
нарушение питания трансплантата вследствие локального воспаления MHC хозяина1
2
Слайд 18
ГУМОРАЛЬНЫЕ МЕХАНИЗМЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
Антитела могут привлекать макрофаги (3)
и естественные киллеры (2) к его разрушению. Более важна
конкуренция антител и Т-клеток за клетки-мишени (1), хотя эту конкуренцию едва ли следует понимать буквально, поскольку В- и Т- эпитопы, как правило, не совпадают
Слайд 19
КЛЕТОЧНЫЕ МЕХАНИЗМЫ РЕАКЦИИ
≪ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА≫
В основе реакции
лежат те же механизмы, которые отвечают за отторжение аллотрансплантата:
перфорин- и Fas-зависимый апоптоз клеток-мишеней, нарушение питания пораженных участков вследствие развития воспаления
Слайд 20
ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
СВЕРХОСТРОЕ ОТТОРЖЕНИЕ - через несколько
часов после пересадки (у реципиентов предварительно сенсибилизированных к антигенам
трансплантата: больные с повторной пересадкой, многочисленными гемотрансфузиями или гемодиализом, много рожавшие женщины);ОСТРОЕ РАННЕЕ ОТТОРЖЕНИЕ - в первые 10 дней после трансплантации (опосредуется ГЗТ);
ОСТРОЕ ОТСРОЧЕННОЕ ОТТОРЖЕНИЕ - после 11 суток после трансплантации ( АЗКЦ );
ХРОНИЧЕСКОЕ ОТТОРЖЕНИЕ - месяцы, годы; развивается если донор и реципиент различаются по слабым локусам HLA (в условиях применения иммунодепрессантов, осуществляется в основном антителами).
Слайд 21
ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
СВЕРХОСТРОЕ ОТТОРЖЕНИЕ -
(минуты-часы) –
предсуществующие анти-НLА (или анти-АВО) антитела реципиента приводят к немедленному
комплемент-зависимому повреждению микрососудистого ложа аллотрасплантата
Слайд 22
ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
ОСТРОЕ РАННЕЕ ОТТОРЖЕНИЕ - «классическая» клеточно-опосредованная
реакция, морфологически характеризующаяся лимфоидно-клеточной инфильтрацией ткани аллотрансплантата. Требует иммуносупрессии.
Слайд 23
ВИДЫ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
ОТСРОЧЕННОЕ ГУМОРАЛЬНОЕ ОТТОРЖЕНИЕ –
-Концентрация предсуществующих
антител или их аффинитет были низкими
-отторжение развивается через
несколько дней после пересадки, необходимых для развития В-клеточного ответа -можно приостановить немедленной процедурой плазмафереза и введением анти-В антител (анти-СD20 - мабтера)
Слайд 24
Подбор совместимой пары донор-реципиент
(типирование тканей по HLA)
а) серологический тест
б) смешанная культура лимфоцитов
(СКЛ)в) типирование цитотоксическими Т-клетками
2. Подавление трансплантационных реакций
а) иммуносупрессоры
б) антилимфоцитарная сыворотка (АЛС)
в) облучение.
ПРЕДОТВРАЩЕНИЕ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
Слайд 25 Аутоиммунные болезни – патологический процесс с выработкой аутоантител
и активизацией клеточной аутореактивности
Слайд 26
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА АУТОИММУННЫХ БОЛЕЗНЕЙ
Основа - аутоиммунная
реакция
Клиническая картина зависит от природы и локализации аутоантигена
(органоспецифическое или органонеспецифичное заболевания)Проявления заболевания зависят от: цитокинового профиля, образования специфических антител или цитотоксических лимфоцитов
Заболевание носит затяжной хронический характер с признаками прогрессирования
Слайд 27
ТЕОРИИ РАЗВИТИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ
НАИБОЛЕЕ УБЕДИТЕЛЬНЫЕ
Теория "запретных" клонов
нарушение
элиминации аутоагрессивных Т- и В-ЛЦ
Теория иммунных дефектов
ассоциации с молекулами
HLA, MHC-II, с генами цитокинов, цепей TCR, супрессорных факторов, инсулина, с поломДОПОЛНИТЕЛЬНЫМИ МЕХАНИЗМАМИ ХРОНИЗАЦИИ
Теория молекулярной мимикрии
- нарушение элиминации аутоагрессивных Т- и В-ЛЦ
Теория развития аутоиммунитета под влиянием суперАГ
- суперАГ активирует большое число Тх-ЛЦ минуя процессинг
Теория поликлональной активации В-лимфоцитов
- стимуляция пролиферации и продукции антител В-ЛЦ
БЛАГОПРИЯТНЫй ФОН ДЛЯ СРЫВА ТОЛЕРАНТНОСТИ
Теория нарушения идиотип-антиидиотипических взаимодействий
- нарушение равновесие “АТ-аутоАТ”
Теория расстройства иммунологической регуляции
нарушение функции Тс-ЛЦ, Тх-ЛЦ и Трег-ЛЦ (регулят. ЦК)
Теория секвестрированных (забарьерных) антигенов
нарушении гистогематического барьера и попадании аутоАГ в кровоток
Слайд 28
АУТОИММУННЫЕ БОЛЕЗНИ
Множесивенный склероз
Полихондрит
Тиреоидит Хошимото
Микседема
Тиреотоксикоз
В12-ДА
ПБЦ
АИГ
Ювенильный панкреатит
БК, НЯК
АИГА, ИТП
Пузырчатка
ОРГАН-СПЕЦИФИЧНЫЕ
СИСТЕМНЫЕ
СКВ
ГВ
ССД
ГВ
Дерматомиозит
СКВ
ГВ
РА
ССД
СКВ
Мозг
Хрящ
Щит.ж.
ЛОР
Желудок
Легкие
Мышцы
Печень
Почки
Кишечник
Поджелуд.жел.
Костный мозг
Кожа
Суставы
Системная
красная волчанка
Ревматоидный артрит
Склеродермия
Дерматополимиозит
Смешанные болезни соединительной ткани
Синдром Шегрена (сухой синдром)
Псориаз
Витилиго
Дерматит
герпетиформныйПузырчатка обычная
Буллезный пемфигоид
Болезнь (синдром Рейтера)
Болезнь Бехтерева
Рассеянный множественный склероз
Острый (пост-)инфекционный полиневрит (синдром Гийена — Барре)
Тяжелая миастения
Тиреоидит Хашимото (аутоиммунный)
Болезнь Грейвса (тиреотоксикоз с диффузным зобом)
Сахарный диабет инсулинзависимый (I типа)
Аутоиммунное поражение надпочечников (болезнь Аддисона)
Аутоиммунная полиэндокринопатия
Саркоидоз
Идиопатический легочный фиброз
Неспецифический язвенный колит
Болезнь Крона (региональный энтерит)
Аутоиммунный гастрит, тип А
Первичный биллиарный цирроз
Хронический активный гепатит
Гломерулонефрит
Слайд 31
ПРИЧИНЫ НАРУШЕНИЯ АУТОТОЛЕРАНТНОСТИ
Нарушение процессов отрицательной селекции, повышающее выживаемость
аутоспецифических клонов
развивающийся ЛЦ не встречает ДК или ЭК, несущую
аутоАГ, при встрече он не получает летальный сигнал в результате дефекта иммунного синапсаотсутствия конкретного аутоАГ в центральном лимфоидном органе
генетически детерминированные нарушения процессов отрицательной селекции (мутацией гена AIRE, Fas (CD95), FasL)
Нарушение периферической аутотолерантности
нарушение анергии аутоспецифических ЛЦ в периферическом звене аутотолерантности
органоспецифическая трансфекция генов MHC-II совместно с генами костимулирующих молекул (при сахарном диабете)
эктопическая индукция экспрессии MHC-II и костимулирующих молекул под действием цитокинов
Недостаточность регуляторных Т-клеток
мутации гена FOXP3, вызывающая сцепленный с Х-хромосомой синдром дисрегуляции иммунитета, полиэндокринопатии, энтеропатии
Преодоление игнорирования антигенов и нарушение их изоляции
нарушение барьеров, изолирующих иммунологически привилегированные органы от иммунной системы
выработка большого количества АГ опухолью с индукцией иммунного ответа
Аутоиммунные процессы, обсуловленные перекрестными реакциями
Слайд 32
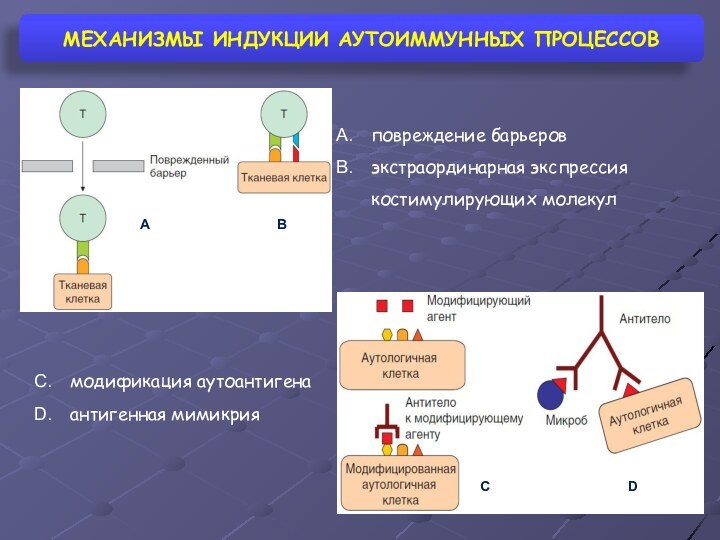
МЕХАНИЗМЫ ИНДУКЦИИ АУТОИММУННЫХ ПРОЦЕССОВ
повреждение барьеров
экстраординарная экспрессия костимулирующих молекул
A
B
C
D
модификация
аутоантигена
антигенная мимикрия
Слайд 33
ГЕНЕТИЧЕСКИ ДЕТЕРМИНИРОВАННЫЕ АУТОИММУННЫЕ МЕХАНИЗМЫ
Аутоиммунные процессы, вызванные мутацией гена
AIRE
Последствия мутации генов, контролирующих факторы рецепторного апоптоза
А
В
Слайд 35
НЕДОСТАТОЧНОСТЬ РЕГУЛЯТОРНЫХ Т-КЛЕТОК
Дефицит регуляторных Т-лимфоцитов, вызванный мутацией гена
дифференцировочного фактора FOXP3 приводит к фатальному развитию полиспецифических аутоиммунных
процессов
Слайд 36
НАРУШЕНИЕ ПЕРИФЕРИЧЕСКОЙ АУТОТОЛЕРАНТНОСТИ
Гомеостатическая пролиферация Т-лимфоцитов как основа развития
аутоимммунных процессов
основную роль играет изменение путей рециркуляции Т-лимфоцитов, в
результате чего аутоспецифические клетки могут контактировать с клетками-мишенями. Важную роль играет нарушение баланса субпопуляций и, возможно, клонов Т-лимфоцитов, приводящее к дефициту регуляторных Т-клеток
Слайд 38
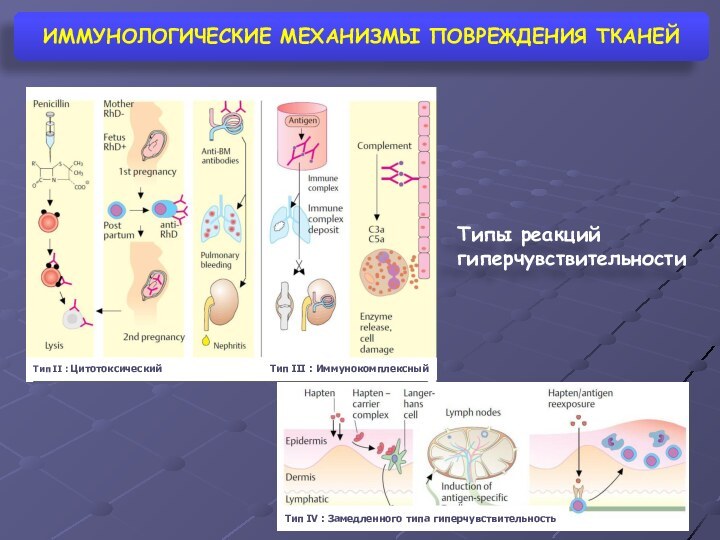
ИММУНОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ
Типы реакций гиперчувствительности
Тип II
: Цитотоксический
Тип III : Иммунокомплексный
Тип IV : Замедленного типа
гиперчувствительность
Слайд 40
МЕХАНИЗМЫ ИНДУКЦИИ АУТОИММУННОЙ РЕАКЦИИ
Т-ЛЦ в стадии покоя
Вирус
Сигнал
Сигнал
АПК
Антигенный пептид
Инсулоцит
Цитотоксикность
Активация
Т-ЛЦ
1. ИНДУКЦИИ АУТОИММУННОГО ОТВЕТА ПУТЕМ АКТИВАЦИИ Т-ЛЦ ВИРУСОМ
Слайд 41
МЕХАНИЗМЫ ИНДУКЦИИ АУТОИММУННОЙ РЕАКЦИИ
АутоАГ
Чужерод.часть
АутоАГ часть
Иммуноглобулин
Процессинг
АутоАТ
В-ЛЦ
Т-ЛЦ
Т-ЛЦ рецептор
HLA ІІ типа
АГ презентация
Стимуляция
2.ИНДУКЦИЯ Т-ЛЦ ВЫРАБОТКИ АУТОАТ
3.ИНДУКЦИЯ ВЫРАБОТКИ АУТОАТ МОЛЕКУЛЯРНОЙ
МИМИКРИЕЙ АутоАГ
Аутологическая клетка
Т-ЛЦ
Вирус
АГ вируса
4.АБЕРРАНТНОСТЬ АНТИГЕНА ВИРУСА К МНС ІІ ТИПА
АГ вируса
HLA ІІ типа АГ
АутоАГ
Т-ЛЦ мишень и вирус
Т-ЛЦ рапознающий АГ вируса
Т-ЛЦ распознающий аутоАГ
цитолиз
Слайд 42
ИММУННЫЕ МЕХАНИЗМЫ ВАСКУЛИТОВ
ИММУННЫЕ ВАСКУЛИТЫ:
аутоАТ ассоциированные
АНЦА: ГВ, микроскопический полиангиит
АЭЦА:
болезнь Такаясу
ИММУНОКОМПЛЕКСНЫЕ
аутоАГ индуцированные: СКВ
ИНФЕКЦИЯ- АССОЦИИРОВАННЫЕ
HBV-гепетит (классический ПА)
HСV-гепетит
ГРАНУЛЕМАТОЗНЫЕ ВАСКУЛИТЫ
(гигантоклеточные)
болезнь Хортонаболезнь Такаясу
ИНФЕКЦИЯ- АССОЦИИРОВАННЫЕ
вирус-ассоциированные: ЦМВ
рикеттсия
спирохета
ОПУХОЛЬ-АССОЦИИРОВАННЫЕ
криоглобулинемия
лимфогранулематоз
волосатоклеточный лейкоз
Слайд 43
ПАТОГЕНЕЗ ГРАНУЛЕМАТОЗА ВЕГЕНЕРА
1. НЕАКТИВНЫЕ ЭК И ГРАНУЛОЦИТЫ
Эндотелиальные клетки
2.
АКТИВАЦИЯ ЭК И ГРАНУЛОЦИТЫ
3. АДГЕЗИЯ ГРАНУЛОЦИТОВ К ЭК
4. ГРАНУЛОЦИТЫ
АКТИВИРУЮТСЯ АНЦАПротеиназа-3
Слайд 44
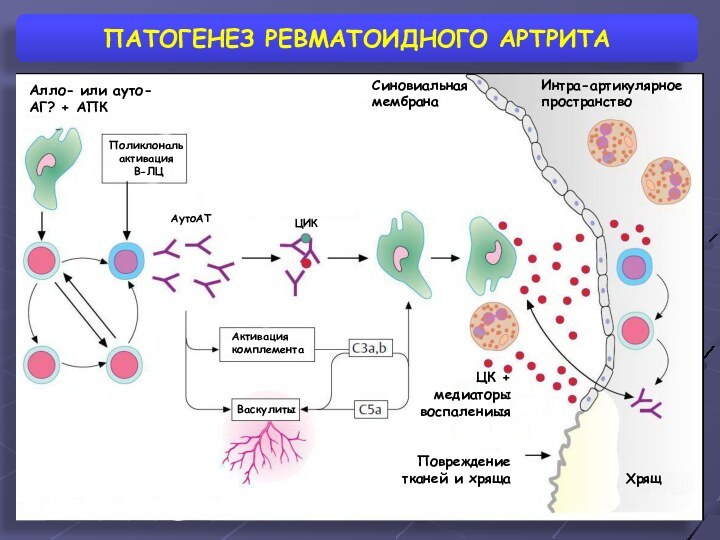
ПАТОГЕНЕЗ РЕВМАТОИДНОГО АРТРИТА
Синовиальная мембрана
Интра-артикулярное пространство
Алло- или ауто- АГ?
+ АПК
Поликлональ активация
В-ЛЦ
АутоАТ
ЦИК
Активация комплемента
Васкулиты
Хрящ
Повреждение тканей и хряща
ЦК +
медиаторы воспалениыя
Слайд 45
Принципы иммунной лабораторной диагностики АИЗ
1. Определение специфических аутоантител
2.
Наличие специфической клеточной сенсибилизации (РБТ и теста ингибиции миграции
лейкоцитов в присутствии соответствующего аутоантигена)3. Определение уровня ЦИК, гамма-глобулина и/или IgG
4. Подсчет количества Т-хелперов и Т-супрессоров, приводящих
к повышению иммунорегуляторного индекса
5. Определение уровня СЗ и С4 компонентов комплемента
6. Определение иммунных комплексов в пораженных тканях (IgG,
IgM, СЗ, С4 и фибрина)
7. Определение лимфоидно-клеточной инфильтрации пораженных тканей
8. Определение HLA-фенотипа
Слайд 46
ИММУНОЛОГИЯ ОПУХОЛЕЙ
ФОРМЫ ВЗАИМОДЕЙСТВИЯ ИММУНИТЕТА И ОПУХОЛИ
ОПУХОЛЕВЫЕ АНТИГЕНЫ
РАСПОЗНАВАНИЕ И
ИДЕНТИФИКАЦИЯ ОПУХОЛЕВЫХ АНТИГЕНОВ
ИММУННЫЙ "МЕХАНИЗМ УКЛОНЕНИЯ"
СОВРЕМЕННАЯ ИММУНОТЕРАПИЯ ОПУХОЛЕЙ
Слайд 48
АНТИБЛАСТОМНЫЕ ИММУННЫЕ ФАКТОРЫ
Клеточные:
Цитотоксические Т-лимфоциты
ЕК- и К-клетки
Активированные макрофаги
Гуморальные:
Специфические
антитела
ИЛ-1
ИЛ-2
ФНО
Интерферон
Слайд 50
ПРОБЛАСТОМНЫЕ ИММУННЫЕ ФАКТОРЫ
Подавляют иммунитет:
Супрессивные вещества -продукты ЛЦ и
МФ
Блокирующие антитела
ЦИК
Простагландины ПГЕ2
ИЛ-10
ТФР-бетта
Усиливают рост опухоли:
Фактор
роста опухоли, продуцируются МФИЛ-2
ИЛ-6
Гамма-интерферон
Фактор роста сосудистого эндотелия
Слайд 52
ПАТОГЕНЕЗ ОБРАЗОВАНИЕ ОНКОАНТИГЕНОВ
Хромосомальные транслокации
Точки мутаций
Объединенный ген
Объединенный пептид =
опухольспецифический
BCR-ABL белок
Клеточный регуляторный протеин
Точки мутаций
Нормальный пептид
Опухольспецифический пептид
HTLV1
Инфицированный Т-ЛЦ
Т-лейкоз взрослых
Вирусный
пептидВирусный пептид
Мутированный или патологический пептид
Слайд 53
ПАТОГЕНЕЗ ОБРАЗОВАНИЕ ОНКОАНТИГЕНОВ
ПРОДУКЦИЯ НОРМАЛЬНОГО ГЕНА
ГИПЕРПРОДУКЦИЯ АНТИГЕНА ОПУХОЛЬЮ
Здоровый меланоцит
Пептид
с тирозиназой
МЕЛАНОМНАЯ КЛЕТКА
ФЕТАЛЬНЫЙ АНТИГЕН
Фетальная печень
Фетальная кишка
Α-фетопротеин
Карциноэмбриональный АГ
Рак кишечника
Рак печени,
яичкаКЛОНАЛЬНЫЙ АНТИГЕН
В-ЛЦ
Т-ЛЦ
IgM
ТРР
Клональная пролиферация
В-клеточная лимфома
Т-клеточная лимфома
Идиотипические АТ или секвестранты ТРР
Слайд 54
ФАКТОРЫ ИММУНОРЕЗИСТЕНТНОСТИ ОПУХОЛЕЙ
Низкая иммуногенность онко АГ.
Дисбаланс в
скорости пролиферации онко и иммунных клеток.
Смена АГ при опухолевой
прогрессии.Селекция иммунорезистентных онкоклеток.
ИЛ-10
Прекращение экспрессии молекул ГКГС-1 на поверхности онкоклеток.
Появление растворимых онко АГ в крови.
Быстрый катаболизм АТ на поверхности.
Продукция супрессорных факторов.
Появление рецепторов к факторам роста.
Индукция апоптоза цитотоксиеских ЛЦ.
Продукция “рецепторов-ловушек”
Слайд 55
МЕХАНИЗМ УСКОЛЬЗАНИЯ ОПУХОЛЕВЫХ КЛЕТОК
ОТ РАСПОЗНАВАНИЯ ИММУННОЙ СИСТЕМОЙ
Гибридный
клон
1. Опухолевый пептид не связывается с ГКГС
2. Нарушение
экспрессии ГКГС клетки опухоли3. Дефект механизма процессинга АГ
4. Отсутствие ко-стимулирующих молекул
5. Вариабельность АГ
6. Ингибиция Т-ЛЦ молекулами, цитокинами
простагландины
Т-ЛЦ
Т-ЛЦ
Т-ЛЦ анергия\апоптоз
Т-ЛЦ анергия
Опухолевые клетки без ГКГС 1 экспрессии
Здоровая клетка с ГКГС 1
Пустая ГКГС 1 молекула
Опухолевый антиген больше не продуцируется
Слайд 58
КЛАССИФИКАЦИЯ МЕТОДОВ ИММУНОТЕРАПИЯ ОПУХОЛЕЙ
Активные
Пассивные
Специфические
Неспецифические
Специфические
Неспецифические
Вакцины:
- на основе цельных опухолевых
клеток, их АГ + адъюванты, в т.ч. геномодифицированных
противовирусные
ДНК-вакцины
идиотипические
на основе
ДКГанглиозиды (GM2, CD2, CD3)
Антиидиотипические антитела
Иммунная РНК
Фактор переноса
Вакцины:
- векторные
- на основе неспецифических АГ
гено-модифицированные
BCG
Аллогенные клетки костного мозга, опред. реакцию “трансплонтант против опухоли”
Аутологические клетки костного мозга
Цитокины
Лимфокины
гормоны тимуса
Иммунотропные препараты
- Моноклональные антитела
- Цитотоксические Т-лимфоциты
- Опухоль-инфильтрирующие лимфоциты
- Лимфокин- активированные киллеры
- Макрофаги
Слайд 59
СОВРЕМЕННАЯ ИММУНОТЕРАПИЯ ОПУХОЛЕЙ
ОПУХОЛИ С ДОКАЗАННЫМ ЭФФЕКТОМ ИММУНОТЕРАПИИ
меланома
гипернефрома
неходжкинские лимфомы
волосатоклеточный лейкоз
рак прямой кишки
рак
яичниковглиома
саркома мягких тканей
Слайд 61
ЦИТОКИНОТЕРАПИЯ ОПУХОЛЕЙ
Вставка цитокин кодирующих генов в опухолевую клетку
(ретровирус,
парвовирус)
Выделение и изоляция опухолевых клеток
Дополнительно добавляют: БЦЖ и т.п.
Постоперационная
инъекцияИнтерферон- α
АКТИВАЦИЯ НЕСПЕЦИФИЧЕСКОГО ИММУНИТЕТА
Адъювантная терапия цитокинпродуцирующими клетками
ХМЛ
Плазмоцитома
Лимфома
Меланома
Гипернефрома
Гипернефрома
Меланома
Лейкозы
Интерлейкин 2
ФНО - α
Локалкое введение при саркомах и меланомах
Цитокиновая терапия
Инфузии цитокинов
Слайд 62
ИНДУКЦИЯ Т-КЛЕТОЧНОГО ОТВЕТА НА ОПУХОЛЬ
Выделение и изоляция опухолевых
клеток
Выделение опухолевый АГ, пептид
Лизат опухолевых клеток
опухолевые клетки
Лизат опухолевых клеток
Аутологическая АПК
Полипептид
ВАКЦИНАЛЬНАЯ СТРАТЕГИЯ
Облучение
П.опер стратегия
Толерантность
ген
ген
Т-ЛЦ активация
ПРЯМАЯ ПРЕЗЕНТАЦИЯ АГ
ПРЯМАЯ ПРЕЗЕНТАЦИЯ АГ
Фагоцитоз опухолевого пептида
АПК
Т-ЛЦ активация
Воздействие пептида АГ
Слайд 63
ВАКЦИНЫ ИЗ ДЕНДРИТНЫХ КЛЕТОК
Активация и стимуляция пролиферации NK-клеток
, Т1-, Т2- клеток, ЦТЛ, ВЛЦ
Экспрессия костимулирующих молекул: CD40,
B7, ICAM, LFA3 и др. Секреция:
ИЛ-12, 1α, 1β, 6, 7, 15, 18, ФНО-α, ИФН-α/β, TGF-β
Миграция в лимфоидную ткань
Захват АГ:
фагоцитоз, эндоцитоз, пиноцитоз
Процессинг и презентация АГ Т-ЛЦ, В-ЛЦ
Дендритная клетка – “профессиональная” антигенпредставляющая клетка
Слайд 64
Процедура получения дендритной вакцины
2. Нагрузка незрелых ДК опухолевым
АГ
3. Инкубация с факторами созревания (ЛПС, цитокины ИЛ1, ГМ-КСФ
и ФНО-α4. Функционально полноценные ДК реинфузируют пациенту
Перспективно использование универсального опухольассоциированного АГ MUC-1, АГ кодируемого генами MAGE, BAGE, GAGE